|
|
Сверхкритическая вода
С недавних пор сверхкритические (флюидные) технологии стали весьма популярны. На Западе их используют для чистки белья, очистки сточных вод и металлов, в пищевой и фармацевтической промышленности, - для экстракции душистых веществ, в синтезе полимеров и даже для производства мелкодисперсных порошков. Это позволяет сократить технологическую цепочку, а значит, снизить стоимость продукции и услуг. Но главное - это экологически чистые процессы. Первое промышленное производство, применяющее сверхкритические флюиды, заработало в 1978 году - это была установка по декофеинизации кофе, за ним в 1982 году последовала промышленная экстракция хмеля (для пивоваренной промышленности). Сегодня на Западе довольно много предприятий работает по этой прогрессивной технологии.
Наиболее популярные сверхкритические флюиды - углекислый газ, вода, пропан, аммиак и некоторые другие соединения с невысокими критическими температурами. Чаще всего используют сверхкритический углекислый газ, поскольку он нетоксичен, дёшев, легко доступен и имеет удобные параметры (Tс = 31°C, Pс = 7,38 МПа). У нас таких предприятий почти нет (НИЦ ЭР „ГОРО" - пожалуй, единственное исключение). Проблема в том, что нет заинтересованности на государственном уровне в новых чистых технологиях, а значит, и желания вкладывать средства.
Впрочем, научные исследования у нас продолжаются, специализированные конференции проводятся, в 2005 году был даже создан Консорциум организаций в области сверхкритических флюидных технологий(Консорциум СКФТ). С октября 2006 года начал выходить специализированный журнал „Сверхкритические флюиды: теория и практика".
Краткий экскурс в историю
Сверхкритическую воду систематически исследуют с начала прошлого века. Однако сегодня эти работы привлекательны не только с теоретической точки зрения. Есть надежда, что самый распространённый, дешёвый, безопасный и экологически чистый растворитель займет свою уникальную нишу в химической промышленности. (Конечно, речь не об обычной воде.)
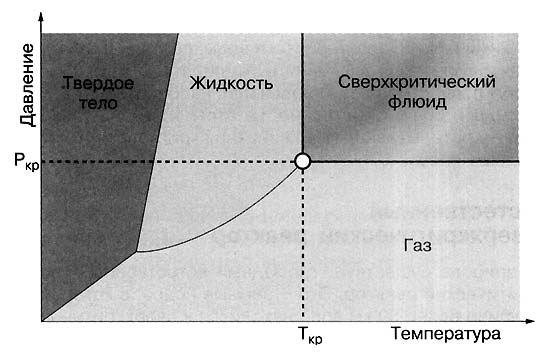
Фазовая диаграмма воды | Сверхкритические состояния первым начал изучать Каньяр де ля Тур в 1822 году. Если любую кипящую жидкость (когдасуществует равновесие между жидкостью и паром) продолжать нагревать и увеличивать давление, то в какой-то момент плотности жидкости и пара становятся одинаковыми, а граница раздела между этими фазами исчезает. В этой критической точке вещество переходит в промежуточное состояние - становится не газом и не жидкостью. При температуре выше критической точки уже двух фаз не получится, хотя если этот однородный флюид сжимать, то его плотность будет меняться от газоподобного к жидкоподобному. При меньших температурах вода находится в докритическом состоянии, а при изменении давления её плотность меняется скачком: жидкость переходит в пар. Выше - в сверхкритическом, вещество однородно, а плотность меняется непрерывно.
В XIX веке химия сверхкритических сред развивалась довольно медленно, и только к концу века вышел первый обзор на эту тему. Во второй половине XX века учёные стали всерьёз задумываться об экологической безопасности и повышении эффективности химических производств и потому заинтересовались веществами в сверхкритическом состоянии (их называют флюидами). И если лет тридцать назад об экологически чистой химии на основе сверхкритических флюидов рассуждали на языке теории, то сегодня на Западе эта область химической технологии активно развивается („Химия и жизнь", 2000, № 2; 2004, № 6).
Таблица
Параметры критического
состояния различных веществ
| Растворитель |
T, К |
P, МПа |
ρ, кг/м3 |
| C2H4 |
282,1 |
5,041 |
214 |
| Xe |
289,5 |
5,840 |
1110 |
| CO2 |
303,9 |
7,375 |
468 |
| C2H6 |
305,2 |
4,884 |
203 |
| N2O |
309,4 |
7,255 |
452 |
| NH3 |
405,3 |
11,350 |
235 |
| C2H5OH |
513,7 |
6,137 |
276 |
| H2O |
646,9 |
22,060 |
322 |
Критическая точка вещества характеризуется критическими значениями температуры, давления и плотности (см. рис.). Разброс этих параметров для различных веществ очень велик (они приведены в таблице), но все они легко достижимы и в лаборатории, и в промышленности. Для технологических процессов лучше всего подходит диоксид углерода - именно его сегодня применяют для экстракции, разделения веществ и многого другого. Сверхкритическую воду пока используют значительно реже, поскольку она становится флюидом при 374°Cи 22,064 МПа, что для практического использования не очень удобно. А между тем в этом состоянии она приобретает ценнейшие свойства. Например, сверхкритическая вода становится почти универсальным растворителем, а также довольно сильным окислителем. Как же это происходит?
Туманный флюид
На самом деле до сих пор нет однозначного ответа на вопрос, каково физическое состояние среды, именуемой флюидом.
Если мы говорим о твёрдых телах, то обычно используем термины „структура", „строение". Это крайне неудачные слова для обозначения того, что происходит в жидкости или газе. Если бы нам каким-то образом удалось получить координаты всех частиц в жидкости, то уже в следующее мгновение эти данные устареют, поскольку положение частиц сильно изменится. Само слово „структура" подразумевает нечто прочное, незыблемое, и это искажает представления о жидком и флюидном состоянии вещества. К сожалению, другого подходящего термина нет. Можно, конечно, говорить о „ближнем порядке", но и это не передает главную особенность флюидного состояния - непрерывно меняющегося движения молекул.
В обычных условиях молекулы воды связаны между собой водородными связями и объединены в трёхмерную сетку, образуя „бесконечный кластер", или агрегаты (H2O)i+1 По мере повышения температуры водородные связи рвутся, а упорядоченность молекулярного строения нарушается. По мнению авторов гипотезы о строении сверхкритической воды (см. журнал „Сверхкритические флюиды", 2007, № 2), выше критической температуры бесконечных кластеров уже нет. В области критической изотермы на фазовой диаграмме в сверхкритическом флюиде существуют только кластеры конечных размеров и молекулы с большим дефицитом водородных связей, свободно вращающиеся в среде. Похоже это на состояние молекул в жидкости? В жидкости преобладают силы притяжения между молекулами (взаимодействие Ван-дер-Вальса, или водородныесвязи) - это условие существования бесконечного кластера. С этой точки зрения сверхкритический водный флюид совершенно не похож на жидкость. Но это и не газ (когда большая часть молекул может свободновращаться), поскольку в такой среде часто возникают конфигурации, типичные для жидкого состояния. Авторы гипотезы называют это состояние транзитным. Получается, что критическая изотерма - это граница существования бесконечного кластера связанных молекул. В общем, с физическим состоянием среды учёным ещё предстоит разбираться.
Уже накоплено много экспериментальных данных по сверхкритическому состоянию воды. Все эти данные подтверждают, что при повышении температуры и давления меняются: её диэлектрическая проницаемость, электропроводность, ионное произведение, структура водородных связей.
Из всех жидкостей вода, наверное, претерпевает самые сильные изменения, переходя в сверхкритическое состояние. Если при нормальном давлении и температуре вода - полярный растворитель, то в сверхкритической воде растворяются почти все органические вещества. Растворимость неорганических веществ также меняется. Даже небольшое отклонение температуры и давления вблизи критической точки изменяет всефизико-химические характеристики воды, поэтому при малейших флуктуациях давления и температуры в такой воде могут полностью растворяться или, наоборот, осаждаться оксиды и соли. Собственно, на этом основана технология гидротермального выращивания кристаллов, которой больше полувека.
Естественный сверхкритический реактор
В природе существует громадный естественный сверхкритический реактор. Это - земные недра, в которых на глубине более 50 км вода находится в сверхкритических условиях. Вода - основа „гидротермального флюида" (геологический термин), то есть горячего, сильно сжатого водного раствора, содержащего много компонентов. Перенося на огромные расстояния растворённые в ней вещества, сверхкритическая вода (скH2O)принимает непременное участие в важнейших геологических процессах: в формировании земной коры, вулканической деятельности, в концентрировании минеральных веществ в земной коре. Можно сказать, что благодаря сверхкритической воде сформировался геологический облик нашей планеты.
По образу и подобию того, что происходит под землёй, исследователи уже почти полвека назад разработали технологию гидротермального синтеза кристаллов. Наверное, это единственная технология на сверхкритической воде, которую уже давно и успешно применяют. Гидротермальный синтез позволяет получать кристаллы неорганических веществ (например, кварца и других оксидов, алюмосиликатов, фосфатови других) в условиях, моделирующих процессы образования минералов в земных недрах. Основан этот метод на способности воды при высоких температурах и давлении растворять оксиды, силикаты, сульфиды и другие вещества, практически нерастворимые в обычных условиях, а при направленном изменении параметров, наоборот, провоцировать их кристаллизацию. Так ежегодно выращивают сотни тонн крупных монокристаллов кварца (массой до 50 кг). По этой же технологии получают искусственные рубины, сапфиры и другие материалы для современной промышленности.
Перспективы
В сверхкритическом состоянии вода (скH2O ) неограниченно смешивается с кислородом, водородом и углеводородами, облегчая их взаимодействие между собой - в ней очень быстро протекают все реакции окисления. Одно из особенно интересных применений такой воды - эффективное уничтожение боевых отравляющих веществ. В смеси с другими веществами скH2O можно использовать не только для окисления, но и в реакцияхгидролиза, гидратации, образования и расщепления углерод-углеродных связей, гидрирования и других.
До- и сверхкритическая вода - это нетоксичный растворитель, свойствами которого можно управлять, подстраивая их под конкретную каталитическую реакцию. В процессах со сверхкритическим флюидом нет проблем с диффузией на границе газ-жидкость (ведь это не газ и не жидкость), а значит, легче регулировать скорость такой реакции. Есть данные, что и процесс отравления катализатора также протекает гораздо медленнее.
Наконец, сверхкритическая вода может быть реагентом или средой для получения нанокристаллических частиц (в частности, оксидных катализаторов) с заданными свойствами, которые уже синтезируют в проточных реакторах. Частицы, образующиеся в таком процессе, имеют примерно один размер и довольно развитую поверхность. Кстати, воду в сверхкритическом состоянии можно использовать для получения не только оксидных, но и других нанокристаллических материалов, например, из аморфного углерода синтезировать углеродные нанотрубки.
Несмотря на всё разнообразие возможных применений до- и сверхкритической воды, она прежде всего важна для решения экологических проблем. Переработка и разложение всё возрастающих количеств неорганических и органических отходов - вот задача, для решения которой понадобится безопасный растворитель практически любых твёрдых соединений. Все традиционные способы - сжигание, жидкофазное окисление или биоразложение - имеют свои недостатки. Так, при сжигании органических отходов образуются токсичные вещества, в частности оксиды азота, которые нужно утилизировать. А биоразложение требует много времени и возможно лишь для нейтрализации отходов, содержащих до 1 мас.% органических веществ.
Переработка органических отходов с использованием скH2O - хорошая альтернатива. По оценке специалистов, строительство предприятия по переработке пиридинсодержащих растворов с помощью сверхкритической воды обойдётся дешевле, чем сжигание и низкотемпературное жидкофазное окисление. Уже есть методы дехлорирования и деароматизации растворов органических соединений, переработки полимеров и пластмасс, окисления коммунальных и пищевых отходов, газификации биомассы, окисления токсичных отходов военно-морского флота, гидролиза целлюлозы и лигнина, а также удаления тяжёлых металлов из различных стоков.
Главная проблема, которая тормозит внедрение технологий со сверхкритической водой, - это довольно высокая стоимость промышленных аппаратов, работающих под большим давлением: для них нужны жаропрочные сплавы и специальная обвязка, исключающая возможность взрывов реакторов. Кроме того, скH2O - агрессивная среда, она вызывает коррозию деталей. Эта проблема, как и отложение солей в трубопроводах, хорошо известна по работе тепловых электростанций. Когда же технические задачи будут решены, а стоимость уже не будет определяющим фактором, останется пробить мощное лобби традиционных химических компаний.
Подготовлено по материалам:
Галкин А.А., Лунин В.В. „Вода в суб- и сверхкритическом состояниях - универсальная среда для осуществления химических реакций", журнал „Успехи химии", 2005, 74 (1).
Горбатый Ю.Е., Бондаренко Г.В. „Сверхкритическое состояние воды", журнал „Сверхкритические флюиды. Теория и практика", 2007, № 2.
Автор благодарит доктора химических наук В.М. Валяшко за помощь в подготовке материала.
|

