Mexidol in complex treatment of glaucoma
E.A. Egorov, N.G. Davydova,
I.A. Romanenko, N.D. Novikova
FGU «MNII GB named after Gelmgoltsa Rosmedbiotechnology»
Department of Ophthalmology of Medical Faculty
GBOU VPO RNIMU Russian National Research Medical University
Moscow
Purpose: to evaluate efficiency and safety of Mexidol solution in complex treatment in patients with POAG of I-III stages.
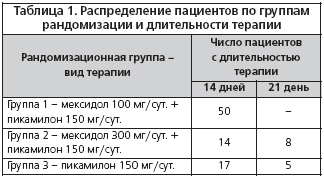
Materials and methods: patients with POAG I-III stages with compensated IOP level (not more than 21 mmHg) were included into the study. All patients were divided into 3 groups: in 1st group Mexidol was prescribed on the background of standard treatment by 100 mg per day intramuscularly, in the 2nd group - on the background of standard treatment by 300 mg per day intramuscularly, 3rd group received standard treatment (picamilonum - by 1 tablet 3 times per day). Patients with I-II stages of glaucoma received treatment during 14 days, with III stage- 21 days. Evaluation of treatment effect was carried out in 30 days after it’s start. External eye examination, visometry, biomicroscopy, ophthalmoscopy, tonometry, computer perimetry , electrophysiologic examination, arterial pressure and heart rate measurements were proceeded on the first, intermediate and last control visits.
Results: Visual acuity was improved in 1st and 2nd group more evidently than in the 3rd one. There was a tendency of improvement of the condition of the visual field (decreasing of the scotoma amount in patients which received Mexidol by 100 mg per day). Increased at the beginning electrosensitivity threshold in patients with I-III stages of glaucoma reduced by the end of the study, and decreased level of the electrical lability of optic nerve raised. Dosage of 300 mg per day was found more efficient than 100 mg per day.
Conclusion: Mexidol could be recommended for inclusion into the complex treatment of patients with glaucomatous neuropathy.
Заболеваемость первичной открытоугольной глаукомой (ПОУГ) по сей день входит в число важнейших медико-социальных проблем. Глаукома является одной из ведущих причин слепоты в развитых странах, поэтому чрезвычайно актуальными остаются вопросы совершенствования диагностики и лечения этого заболевания.
Этиопатогенез глаукомы сложен и, несмотря на многочисленные исследования, до конца не изучен. Есть все основания считать, что он имеет мультифакторный характер [5,8]. Глаукомная оптическая нейропатия (ГОН) обусловлена действием различных факторов, приводящих к апоптозу ганглиозных клеток сетчатки: сдавлением аксонов зрительного нерва в отверстиях решетчатой пластинки, смещенной кзади вследствие повышенного внутриглазного давления (ВГД), нарушением кровоснабжения головки зрительного нерва, образованием избытка свободных радикалов вследствие ишемии и усилением перекисного окисления липидов (ПОЛ). При ишемии в нервной ткани происходят торможение белкового синтеза и активация анаэробного гликолиза, далее нарушается работа К-Na помпы и возникает деполяризация мембран клеток. В ответ на это происходит выброс глутамата, который активизирует нейроны через NMDA-рецепторы, приводя к поступлению избыточного количества ионов кальция в клетку. Чрезмерно высокая концентрация Ca2+ в клетках запускает активацию сложных каскадов нуклеаз, протеаз и липаз [7]. Они непосредственно воздействуют на внутриклеточные белки и липиды, в результате чего образуются активные свободные радикалы, а также чрезмерное количество оксида азота (NO), который может способствовать развитию ГОН. Образуются различные активные формы кислорода, которые оказывают цитотоксическое действие на сетчатку, зрительный нерв, приводят к деструктивным изменениям в дренажной системе [3]. По сути дела, механические и сосудистые факторы реализуют свои эффекты посредством метаболических процессов.
Таким образом, становится очевидным, что помимо нормализации уровня ВГД лечение пациентов с глаукомой обязательно должно быть направлено на коррекцию метаболических нарушений в головке зрительного нерва, улучшение местной микроциркуляции и трофики тканей, а также нормализацию реологических свойств крови, увеличение основного и коллатерального кровообращения [4].
Одним из важных направлений в лечении глаукомы является нейропротекторная терапия. Нейропротекция подразумевает защиту сетчатки и волокон зрительного нерва от повреждающего действия различных факторов. Нейропротекторы прямого действия непосредственно защищают нейроны сетчатки и волокна зрительного нерва за счет блокирования прямых факторов повреждения клеток, вызывающих увеличение концентрации продуктов ПОЛ и свободных радикалов, ионов Са2+, ацидоз.
К таким лекарствам относится Мексидол - сукцинат 2-этил-6-метил-3-оксипиридина, синтезированный в начале 1980-х гг. Л.Д. Смирновым и В.И. Кузьминым. Этот препарат обладает поликомпонентным спектром фармакологических эффектов и многофакторным механизмом действия. Наиболее важными компонентами действия Мексидола являются его антиоксидантные, мембранотропные свойства, способность модулировать функционирование рецепторов и мембраносвязанных ферментов и восстанавливать нейромедиаторный баланс.
Мексидол влияет прежде всего на процессы свободно-радикального окисления в биологических мембранах и внутри клетки. Он обладает способностью ингибировать процессы ПОЛ, активно реагирует с первичными и гидроксильными радикалами, снижает повышенный при патологии уровень NO, а также повышает активность антиоксидантных ферментов (в частности, супероксиддисмутазы), ответственных за образование и расходование перекисей липидов и активных форм кислорода [1].
Препарат оказывает модулирующее влияние на активность мембраносвязанных ферментов и рецепторных комплексов за счет повышения содержания полярных фракций липидов (фосфатидилсерина и фосфатидилинозита), способствует уменьшению вязкости мембран и увеличению их текучести, повышает соотношение липид-белок. Показано, что Мексидол является антигипоксантом прямого энергизирующего действия, эффект которого связан с влиянием на эндогенное дыхание митохондрий, активацией их энергосинтезирующей функции. Действие Мексидола обусловлено усилением компенсаторных метаболических потоков, поставляющих в дыхательную цепь энергетические субстраты, в данном случае сукцинат. Это позволяет восстановить нарушенный в условиях кислородной недостаточности процесс окислительного фосфорилирования, связанного с ограничением НАДН-оксидазного пути окисления. Антиоксидантное и мембранопротекторное действиеМексидола ограничивает разрушающее действие продуктов ПОЛ и способствует стабилизации мембран клеток, сохранению их упорядоченной структурно-функциональной организации, необходимой для функционирования мембраносвязанных рецепторных комплексов, ферментов и ионных каналов [2].
Наряду с этим Мексидол стабилизирует мембранные структуры клеток крови (эритроцитов и тромбоцитов), обладает гиполипидемическим действием, снижает в плазме крови уровень общего холестерина и липопротеидов низкой плотности.
Таким образом, установлено, что Мексидол обладает широким спектром фармакологических эффектов, реализуемых, по крайней мере, на двух уровнях - нейрональном и сосудистом. Мексидол оказывает нейропротекторное, ноотропное, противогипоксическое, противоишемическое, антистрессорное, анксиолитическое, противосудорожное, вегетотропное, кардиопротекторное, антиатерогенное, геропротекторное, антиалкогольное и др. действия. Под влиянием Мексидола наблюдается улучшение мозгового кровообращения и микроциркуляции [6].
На базе кафедры офтальмологии им. А.П. Нестерова лечебного факультета РНИМУ им. Н.И. Пирогова и МНИИ ГБ им. Гельмгольца было проведено открытое рандомизированное контролируемое сравнительное исследование. Цель настоящего исследования - оценить эффективность и безопасность отечественного препарата Мексидол раствор для внутривенного и внутримышечного введения в дозе 100 мг/сут. и 300 мг/сут. в составе комплексной терапии у пациентов с ПОУГ I-III стадий.
Материалы и методы
В исследование включались пациенты с ПОУГ I-III стадий с компенсированным уровнем ВГД - не выше 21 мм рт.ст. (по Гольдману), способные понять суть исследования и дать письменное согласие на участие в данном клиническом исследовании. Критериями исключения служили: возраст моложе 18 и старше 75 лет; единственный глаз; повышенная чувствительность к любому из компонентов препарата; хирургические и лазерные вмешательства на глазном яблоке в течение последних 3 мес.; выраженные помутнения оптических сред глаза, препятствующие оценке эффективности лечения; наличие других заболеваний глаз, которые могли оказать влияние на динамику показателей, использующихся для оценки эффективности лечения(диабетическая ретинопатия, дисциркуляторные нарушения в сосудах сетчатки и т.д.); применение в качестве сопутствующей терапии бензодиазепиновых анксиолитиков, противосудорожных и противопаркинсонических средств; острые нарушения функции печени и почек; беременность, лактация; участие в другом клиническом исследовании в последние 3 мес.
Пациенты были рандомизированно распределены на 3 группы: первой группе на фоне стандартной терапии был назначен Мексидол в дозе 100 мг/сут. внутримышечно; второй группе на фоне стандартной терапии назначался мексидол в дозе 300 мг/сут. внутримышечно; третья группа пациентов получала стандартную системную терапию. В качестве стандартной терапии использовался пикамилон (производства ОАО «Фармстандарт-УфаВИТА») в таблетках по 0,05 г 3 раза в день. Пациенты с I и II стадиями глаукомы получали 14-дневную терапию, с III стадией - 21-дневную. Распределение пациентов по группам представлено в таблице 1.
Оценка эффективности и переносимости терапии проводилась на 30-й день от начала терапии.
Всем пациентам во время первого, промежуточных и заключительного визитов проводились следующие исследования: наружный осмотр глаза, визометрия, биомикроскопия, прямая офтальмоскопия, тонометрия по Гольдману, компьютерная периметрия, электрофизиологическое исследование ЭФИ (электрофосфен), определение уровня артериального давления (АД) и частоты сердечных сокращений (ЧСС). Компьютерная статистическая надпороговая периметрия была выполнена с помощью отечественного автоматического периграфа «Периком» (ООО СКТБ ОП «Оптимед», Москва). Исследование проводилось по программе «Глаукома» (сокращенный скрининг - 70%). ЭФИ на аппарате «ЭСОМ» (электростимулятор офтальмологический микропроцессорный) (МНПП «Нейрон», Уфа) включало определение порогов электрической чувствительности глаза (ПЭЧ) и лабильности (ЭЛ) аксиального пучка зрительного нерва. Проводилась оценка динамики функционального состояния органа зрения до курса терапии и по его окончании.
Критерии эффективности: улучшение показателей компьютерной периметрии (уменьшение числа скотом первого и второго порядка, абсолютных скотом), снижение изначально повышенного порога электрической чувствительности и повышение сниженной электрической лабильности зрительного нерва, повышение остроты зрения, снижение уровня ВГД. Оценка безопасности проводилась на основе субъективных и объективных явлений непереносимости (изменения АД, ЧСС), а также путем регистрации нежелательных явлений (НЯ).
Статистическая обработка полученных результатов проводилась с использованием пакета прикладных программ Statistica 7.0. Рассчитывались медианы и интерквартильные интервалы (для количественных показателей с отличным от нормального видом распределения), относительные частоты (для качественных данных). Оценка значимости различия медиан в зависимых выборках проводилась с использованием непараметрического критерия Манна-Уитни при распределении, отличном от нормального, или при различных дисперсиях, и с помощью критерия Стьюдента при нормальных распределениях (сравнение средних значений). Для оценки динамики и влияния факторов на признаки использовался дисперсионный анализ (однофакторный и анализ для зависимых выборок) и его непараметрический аналог - критерий Фридмана. Для оценки распределения значений показателей ЭФИ по категориям «норма» и «отклонение» использовались таблицы сопряженности.
Оценка эффективности терапии
В статистический анализ были включены данные 93 пациентов (185 глаз) из 94 скиринованных, т.к. один пациент выбыл из исследования через 2 дня в результате НЯ, не связанного с приемом препарата.
При анализе показателей визометрии без коррекции у пациентов с I-II стадиями глаукомы во всех трех группах статистически достоверных различий не выявлено. На заключительном визите у пациентов 1-й и 2-й групп были отмечены большие по сравнению с началом исследования значения медиан оцениваемого показателя, у пациентов
3-й группы (контрольной) значения остроты зрения без коррекции остались на прежнем уровне.
У пациентов с III стадией глаукомы (группы 2 и 3) статистически достоверных различий также выявлено не было, однако на завершающих визитах показатели были выше исходных с различиями, близкими к значимым (p=0,1), что может свидетельствовать о положительном влиянии всех видов проведенной терапии. При этом разница медиан значений остроты зрения в контрольной группе, полученных на первом и последнем визитах, оказалась несколько ниже аналогичного показателя в группе 2 (Мексидол 300 мг/сут. + пикамилон 150 мг/сут.).
Приведенные данные могут свидетельствовать в пользу исследуемой терапии - сочетания инъекционных форм Мексидола с пероральным приемом пикамилона.
По результатам визометрии с коррекцией у пациентов с I и II стадиями глаукомы достоверных различий между всеми тремя группами не отмечалось, при этом на завершающих визитах показатели были выше исходных с различиями, близкими к значимым (p=0,059). Примечательно, что пациенты, рандомизированные в группы 1 и 3 (контрольную), изначально имели остроту зрения с коррекцией, близкую к 1,0. У всех пациентов с III стадией глаукомы зафиксировано сопоставимое значимое увеличение показателей (р=0,01).
В связи с тем, что компьютерная периметрия выполнялась в двух центрах на разных приборах, для статистической обработки были использованы только данные пациентов, наблюдавшихся в МНИИ ГБ им. Гельмгольца (38 пациентов, из них 28 страдали ПОУГ I-II стадий и относились к группе 1).
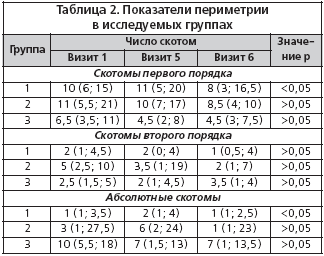
При анализе выявленных скотом первого порядка установлена достоверная разница (р<0,05) в их количестве между первым и шестым визитами у пациентов группы 1 (табл. 2). Статистически достоверное различие в количестве абсолютных скотом и скотом второго порядка (р<0,03) выявлено между группами только на первом визите, в последующем данные различия были нивелированы.
Полученные данные могут свидетельствовать о неоднородности групп по перечисленным показателям периметрии на момент включения пациентов в исследование. Тем не менее, в отношении полей зрения зафиксирован положительный терапевтический эффект сочетания Мексидола в дозе 100 мг/сут. с пикамилоном в дозе 150 мг/сут. у пациентов с начальной и развитой стадиями глаукомы.
При оценке показателей ПЭЧ и ЭЛ было выявлено, что у некоторых пациентов обе эти величины находятся в пределах нормы (табл. 3).
Данная когорта была исключена из дальнейшей статистической обработки. Параметры остальных пациентов следовало анализировать в зависимости от диагноза (ПОУГ I-II и III стадий). При этом выяснилось, что число пациентов с глаукомой I и II стадий, имевших отклонения ПЭЧ и/или ЭЛ и входивших в группы 2 (Мексидол 300 мг/сут. + пикамилон 150 мг/сут.) и 3 (пикамилон 150 мг/сут.), составило 2 и 1 человек соответственно. Поэтому динамика показателей ЭФИ оценивалась только для пациентов группы 1 (Мексидол 100 мг/сут. + пикамилон 150 мг/сут.). Положительным терапевтическим эффектом считалось снижение изначально повышенных показателей ПЭЧ и/или увеличение субнормальной лабильности.
У пациентов с I и II стадиями глаукомы до начала лечения отмечались умеренное повышение порога электрической чувствительности до 114±39,05 мкА, что составляет 143% от значений для здоровых лиц, и снижение лабильности зрительного нерва до 23,55±3,52 Гц (79% от нормы). Показатели, зафиксированные после проведенного лечения, свидетельствуют о достоверной эффективности терапии: ПЭЧ снизился до 84,5±26,77 мкА (р=0,0039), а значение ЭЛ возросло до субнормальных значений - 26,76±4,90 Гц (р=0,00538).
Распределение по рандомизационным группам пациентов с III стадией глаукомы, у которых на исходном визите выявлено отклонение от нормы показателей ПЭЧ и/или ЭЛ, было также неравномерным. При сравнении показателей ЭЛ между группами 2 и 3, а также в начале и в конце наблюдения статистически значимых различий не выявлено.
Одновременно с этим зафиксировано статистически значимое (р=0,003921) снижение во времени показателей порога электрической чувствительности с 146,69±40,02 мкА (183% от нормы) до субнормальных значений (83,02±18,46 Гц, или 104% от нормы) в суммарно оцениваемой популяции; при этом влияние фактора взаимодействия времени наблюдения и рандомизации было менее достоверным, но близко к значимому (p=0,085). Так, средние исходные величины ПЭЧ в исследуемых группах составили 181,66±66,96 мкА (226% от нормы) и 111,71±43,83 мкА (140% от нормы) для второй и третьей групп соответственно. По окончании терапии средние значения ПЭЧ были в целом ниже и составили 82,71±40,41 мкА (103% от нормы) во второй и 83,33±30,89 мкА (104% от нормы) в третьей группах.
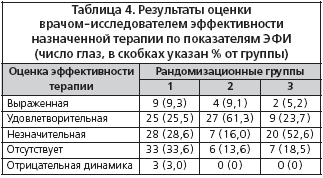
Также проводилась оценка эффективности проводимой терапии врачом-исследователем. Результаты представлены в таблице 4.
Из таблицы видно, что наибольшая эффективность в отношении показателей ЭФИ зафиксирована у пациентов, получавших терапию Мексидолом в дозе 300 мг/сут. в сочетании с пикамилоном, - более чем у половины испытуемых (61,3% глаз) была отмечена удовлетворительная динамика показателей ЭФИ. Эффективность терапии у пациентов 1-й группы (Мексидол 100 мг/сут. + пикамилон) в примерно равном проценте случаев расценена как удовлетворительная (25,5%,), незначительная (28,6%) или без существенной динамики (33,6%). Большая часть (52,6% глаз) пациентов, составивших 3-ю группу (монотерапия пикамилоном), продемонстрировала незначительную динамику показателей ЭФИ.
Таким образом, в результате исследования выявлена положительная динамика показателей электрофизиологических исследований во всех исследуемых группах.
Оценка безопасности приема лекарственных средств в ходе исследования проводилась на основе регистрации субъективных и объективных явлений непереносимости и НЯ. Измерение параметров гемодинамики проводилось на первом и третьем визитах. Усредненные показатели АД и ЧСС представлены в таблице 5.
Из таблицы видно, что исходные значения уровня АД находились на уровне верхней границы нормы либо соответствовали уровню артериальной гипертензии I степени, что связано с возрастом пациентов и сопутствующей патологией. Однако при оценке гемодинамических параметров за период наблюдения не было выявлено значимого повышения или снижения уровня систолического и диастолического АД и ЧСС.
В ходе проведения исследования было отмечено три случая НЯ. У первого пациента, включенного в 3-ю группу наблюдения (пикамилон по 0,05 г 3 раза в день, 21 день), на второй день исследования повысился уровень АД до 200/110 мм рт.ст. В связи с ухудшением общего состояния пациент был госпитализирован, пикамилон отменен. НЯ не связано с приемом препарата, пациент выбыл из исследования. У второй пациентки, заканчивающей лечение согласно протоколу, было зарегистрировано побочное явление, проявившееся в уплотнении ткани в зоне внутримышечного введения Мексидола. Данная пациентка находилась в группе наблюдения, где применялись высокие дозы препарата (300 мг/сут.) в течение длительного времени - 21 день. Применение физиотерапевтических процедур позволило добиться полного рассасывания инфильтратов. У третьей пациентки на 3-й день терапии (Мексидол в дозе 300 мг/сут. внутримышечно в сочетании с пикамилоном 0,05 г 3 раза в день в течение 21 дня) наблюдались головокружение и тяжесть в голове. Терапия была временно отменена. После возобновления лечения симптомы НЯ более не наблюдались. Остальные пациенты завершили исследование в соответствии с протоколом и отметили хорошую переносимость принимаемых препаратов.
Проанализированные результаты открытого сравнительного исследования эффективности и безопасности препарата Мексидол в лекарственной форме раствор для инъекций в составе терапии у пациентов с открытоугольной глаукомой различных стадий свидетельствуют о хорошей переносимости и безопасности препарата. Выявленные НЯ, связанные с назначением данной терапии, относятся к несерьезным, а вероятность их появления учтена в инструкциях по медицинскому применению исследуемых лекарственных средств.
Выводы
1. В состав комплексной терапии больных ПОУГ различных стадий предложено включить патогенетически направленный препарат Мексидол, обладающий антиоксидантным действием.
2. В ходе клинического исследования были выявлены положительные терапевтические эффекты Мексидола, которые выражались:
• для терапевтических доз 100 мг/сут. и 300 мг/сут. - в увеличении остроты зрения (по данным визометрии без коррекции у пациентов с I-II и III стадиями глаукомы, по данным визометрии с коррекцией у пациентов с I-II стадиями глаукомы), а также в снижении повышенного до лечения порога электрочувствительности и повышении сниженной электрической лабильности зрительного нерва у пациентов с I-II и III стадиями глаукомы (по данным ЭФИ);
• для терапевтической дозы 100 мг/сут. - в снижении числа скотом 1-го порядка при оценке результатов компьютерной периметрии.
3. Выявлена некоторая зависимость выраженности терапевтического эффекта препарата Мексидол от дозы: по данным визометрии у пациентов с III стадией глаукомы, оценки динамики ВГД у пациентов с I-II стадиями глаукомы, оценки уровня снижения порога электрочувствительности зрительного нерва у пациентов с III стадией глаукомы большей эффективностью обладал Мексидол в дозе 300 мг/сут.
4. В ходе клинического исследования подтверждена хорошая переносимость препарата Мексидол в лекарственной форме раствор для инъекций при его назначении пациентам с различными стадиями открытоугольной глаукомы в дозах 100-300 мг/сут. внутримышечно в течение 14-21 дня.
5. Благодаря мембранопротекторному, ноотропному, антигипоксическому и антиоксидантному действию Мексидол может с успехом применяться в комплексной терапии глаукомной оптической нейропатии как на ранних, так и на поздних стадиях заболевания.


Литература
1. Воронина Т.А. Антиоксидант мексидол. Основные эффекты и механизм действия // Психофармакол. и биол. наркология. - 2001. - № 1. - С. 2-12.
2. Воронина Т.А., Середенин С.Б. Ноотропные препараты, достижения и новые проблемы // Экспер. и клинич. фармакология. - 1998. - Т. 61. - № 4. - С. 3-9.
3. Курышева Н.И. Глаукомная оптическая нейропатия. - М.: МЕДпресс-информ, 2006. - 136 с.
4. Национальное руководство по глаукоме: для практикующих врачей / Под ред. Е.А. Егорова, Ю.С. Астахова, А.Г. Щуко. - М.: ГЭОТАР-Медиа, 2011. - 280 с.
5. Нестеров А.П. Глаукома. - М.: ООО «Медицинское информационное агентство», 2008. - 360 с.
6. Румянцева С.А., Федин А.И., Сохова О.Н. Антиоксидантная терапия ишемических поражений головного мозга // Журн. неврол. и психиат. - 2011. - № 4. - С. 28-31.
7. Osborne N.N., Wood J.P., Chidlow G. et al. Ganglion cell death in glaucoma: what do we really know? // Br. J. Ophthalmol. - 1999. - Vol. 83. - № 8. - P. 980-986.
8. Quigley H.A., Broman A.T. The number of people with glaucoma worldwide in 2010 and 2020 // Br. J. Ophthalmol. - 2006. - Vol. 90. - № 3. - P. 262-267.
9. Румянцева С.А., Федин А.И., Сохова О.Н. Антиоксидантная терапия ишемических поражений головного мозга. // Журн. неврол. и психиат. - 2011. - № 4. - С. 28-31.

