Введение
В современной эстетической медицине существует много хирургических и аппаратных методик, предполагающих повреждения (нарушения) кожи. Эти методики основаны на предположении о хорошем уровне репаративных возможностей кожи пациента. На практике, однако, наблюдается несколько иная картина. Например, у пожилых пациентов ранозаживление существенно замедлено, более того, его качество оставляет желать лучшего. У пациентов, «увлекающихся» пластической хирургией в молодом и среднем возрасте, попросту не хватает репаративных ресурсов кожи вследствие недостаточных по времени интервалов для ее реабилитации.
Помимо классических «резаных ран» современная эстетическая медицина включает некоторые методики, приводящие к термальным ожогам (лазерный пилинг), химическим ожогам (химический пилинг) и др., что также предъявляет повышенные требования к репаративным возможностям кожи пациента. Поэтому даже при условии выполнения эстетических аппаратных процедур и хирургической пластики на высоком технологическом уровне пациенты нуждаются в адекватном ведении в предоперационном и реабилитационном периодах. Реабилитационный (послеоперационный) период особенно важен, так как в это время высока вероятность развития осложнений (замедленное ранозаживление, формирование грубой рубцовой ткани с последующим изменением окраски кожи, спаечной болезни, инфекционных осложнений ран и др.).
Качественное ранозаживление необходимо каждому пациенту после оперативного вмешательства. В стандартной ранозаживляющей терапии помимо топического воздействия (растворы, спреи, гели, кремы, мази) применяются препараты - стимуляторы ранозаживления, такие как солкосерил (стандартизированный экстракт плазмы крови молодых телят) и др. Актуальность вопроса заключается в том, что, несмотря на несомненные успехи в лечении ран и ожогов, желаемая степень терапевтического и косметического эффекта достигается далеко не всегда. Следовательно, любая возможность ускорения и, особенно, улучшения качества заживления раны заслуживает внимательного рассмотрения.
Очевидно, что ранозаживление - показатель состояния репаративных возможностей соединительной ткани (СТ). СТ составляет около 50% массы тела. С гистологической точки зрения, СТ - это не только фасции и связки, но и вся система клеточного обеспечения целостности всех видов тканей и органов [7]. Иначе говоря, основная функция СТ - это структурная поддержка других тканей, что чрезвычайно важно в процессах ранозаживления [4].
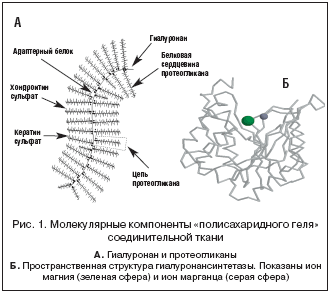
С точки зрения современной молекулярной биологии, СТ состоит из четырех принципиальных компонентов: клеток (фибробластов), гелеобразной среды (или «аморфного вещества», обеспечивающего быструю диффузию питательных веществ и гормонов между кровью и клетками СТ), коллагеновых и эластиновых волокон (механическая поддержка) [12]. Гелеобразная среда формируется протеогликанами - чрезвычайно растянутыми белковыми цепями с многочисленными полисахаридными цепями глюкозаминогликанов, присоединенных посредством ковалентных связей (рис. 1а). Основой гелеобразной среды СТ является биополимер гиалуронан, нити которого скрепляют структуру «полисахаридного геля» в единое целое. Гиалуронан синтезируется посредством магний-зависимых ферментов гиалуронансинтетаз (рис. 1б).
Следует отметить, что эссенциальный биоэлемент магний необходим для обеспечения энергетического метаболизма клеток кожи, полноценного обмена белков, жиров, углеводов, нуклеиновых кислот [2] и оказывает значительное влияние на структуру СТ. Совместное рассмотрение молекулярной биологии внеклеточной матрицы и физиологических механизмов гомеостаза магния [5] позволило сформулировать ряд принципиально важных молекулярных механизмов взаимосвязи между Mg2+ и состоянием СТ:
• стабилизация магнием транспортных РНК, участвующих в синтезе белка;
• активация магнием гиалуронансинтетаз (рис. 1б);
• деактивация матричных металлопротеиназ, избыточная активность которых приводит к разрушению СТ;
• активация эластаз, способствующих формированию гибких эластиновых волокон.
Эти молекулярные механизмы, подробно рассмотренные в работе [5], указывают на фундаментальное значение магния для роста и восстановления СТ и на то, что препараты магния могут быть весьма полезны для оптимизации процессов ранозаживления.
Результаты анализа фундаментальных молекулярных исследований ролей магния в структуре СТ подтверждаются результатами экспериментальных и клинических исследований повреждений кожи. В исследовании Berger с соавт. [7] в группе 16 пациентов с термическими ожогами было установлено, что тяжесть ожога коррелировала с экссудативными потерями магния (r=0,07, р=0,003). В эксперименте Heidarianpour [8] на стрептозацин-индуцированном диабете показано, что пероральный прием сульфата магния снимает спазм с микрососудов кожи, воздействуя на каскад оксида азота. В эксперименте Williams с соавт. (1994) с химическим ожогом фторной кислотой дотация магния (инъекции 160 мг/кг массы тела сульфата магния) уменьшала тяжесть ожога, снижалась смертность. В эксперименте Silva с соавт. [11] добавление в крем для кожи магния аскорбил фосфата способствовало утолщению эпителия кожи с большим объемом клеток в области гранулирования раны.
Ультрафиолет-зависимое старение кожи очень распространено. Классическими защитными средствами являются крем с УФО-фильтрами и пероральное применение ликопина. При лечении угревой сыпи и реабилитации пациентов, перенесших химические и лазерные пилинги, а также пациентов, которым были проведены пластические операции, существует большая вероятность неравномерного окрашивания кожи в районе вмешательства (особенно при его проведении весной и летом).
В то же время магний является независимым и весьма важным протектором, защищающим кожу от УФО-повреждений и нормализующим пигментацию. В эксперименте Kobayashi с соавт. [10] с УФО-облучением крыс с предварительно депилированной шерстью внутрибрюшинное введение магния аскорбил фосфата предотвращало избыточный оксидативный стресс и воспаление кожи. В клиническом исследовании Kameyama с соавт. [9] однократная дотация магния (местное применение крема) 34 пациентам снижала гиперпигментацию кожи при ее УФО-облучении.
Таким образом, использование препаратов органического магния для восстановления структуры СТ является перспективным направлением биомедицинских исследований в области эстетической медицины. В настоящем исследовании проводилось экспериментальное изучение влияния органической формы магния (препарат Магнерот®, оротат магния) на процессы заживления ран и ожогов на стандартных международных моделях ран и ожогов у животных. В качестве препарата сравнения использовался солкосерил, входящий в стандартную терапию.
Оротат магния способствует более активному всасыванию магния в желудочно-кишечный тракт. Кроме того, оротовая кислота принимает участие в обмене белков и фосфолипидов, в превращениях фолиевой и пантотеновой кислот. Препараты оротовой кислоты, в частности оротат калия, применяются в качестве стимуляторов лейкопоэза и регенерации клеток, в том числе клеток СТ. Поэтому использование оротата магния при приеме внутрь является перспективным направлением исследований по улучшению процессов ранозаживления.
Материалы и методы
Эксперимент выполнен в соответствии с этическими стандартами по биомедицинской этике. Все процедуры по уходу за экспериментальными животными осуществляли в соответствии с нормами и правилами обращения с лабораторными животными и с учетом требований Европейской конвенции по защите экспериментальных животных (1973).
Эксперимент проводился на 60 белых крысах-самцах линии Вистар (масса тела - 200-300 г, возраст - 3 мес.). Критериями отбора для участия в эксперименте наряду с полом и массой тела служили общее состояние животных, активное поведение, гладкая блестящая шерсть и чистый кожный покров, отсутствие внешних признаков заболеваний. На основании результатов отбора крысы были рандомизированы и разделены на 6 групп по 10 животных (табл. 1).
I и IV группы являлись контрольными; II и V группы включали препарат сравнения и служили для моделирования стимулированной регенерации. В качестве препарата сравнения использовался широко применяющийся в клинике и в эксперименте препарат солкосерил - стандартизованный депротеинизированный диализат из крови молочных телят, содержащий широкий спектр естественных низкомолекулярных веществ, в т.ч. гликолипиды, нуклеозиды и нуклеотиды, аминокислоты, олигопептиды, микроэлементы. III и VI группы (Магнерот®, модель «Рана», Магнерот®, модель «Ожог») позволили оценить ранозаживляющие эффекты оротата магния.
Для создания травматической модели на коже спины в межлопаточной области после депиляции удалялся полнослойный кожный лоскут размерами 1,5x1,5 см. Ожоги той же локализации воспроизводились после депиляции путем прикладывания к ограниченному деревянным трафаретом круглому участку кожи диаметром 1,5 см тонкостенной резиновой емкости с водой температуры 90С на 30 с. Предварительные испытания показали, что данная методика позволяет воспроизводить стандартный по размеру и глубине ожог III степени. Болезненные манипуляции проводились под хлоралгидратным наркозом (350 мг/кг внутрибрюшинно), в соответствии со стандартными протоколами [3,6].
На всем протяжении эксперимента рана оставалась открытой. Для исключения зализывания раны крысы содержались в индивидуальных клетках. Введение препаратов осуществлялось в одно и то же время 1 раз в cутки 5 дней в неделю. Регулярно проводились планиметрические измерения раны, учитывались сроки завершения эпителизации. На 30-й день под хлоралгидратным наркозом (700 мг/кг внутрибрюшинно) забирался полнослойный участок кожи с рубцом. Кусочки кожи с ран животных фиксировались в нейтральном формалине и обезвоживались в спиртах восходящей концентрации. Парафиновые срезы толщиной 5 мкм готовились в направлении поперек продольной оси межлопаточной области и окрашивались гематоксилин-эозином и резорцин-фуксином по Вейгерту. Морфологические исследования проводились с помощью микроскопа «Биолам Р-5» и анализатора видеоизображений «ВидеоТест-Мастер».
Полученные результаты были подвергнуты математической обработке с помощью компьютерной программы Microsoft Excel. При стандартном анализе определяли среднее арифметическое, стандартное отклонение среднего арифметического, величину доверительных интервалов. Достоверность различий сравниваемых величин определялась при помощи t-критерия Стьюдента и непараметрического U-критерия Уилкоксона-Манна-Уитни. Достоверными различия считались при p<0,05.
Результаты
В результате исследования были установлены достоверные различия в эффективности и скорости ранозаживления и качестве образующегося рубца (по данным гистологического исследования образцов тканей на 30-й день). Внутрижелудочное зондирование суспензией оротата магния способствовало более эффективному и быстрому по сравнению с контролем заживлению моделей ран и ожогов, причем эффект оротата магния был сравним с эффектом внутрибрюшинного введения солкосерила.
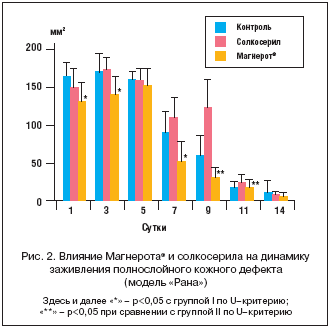
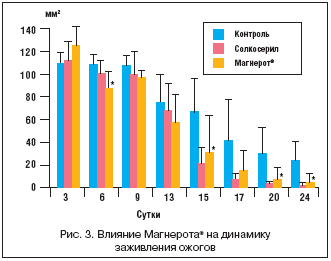
Различия в динамике площади раневой поверхности представлены на рисунке 2. Эффект оротата магния на площадь раны был заметен начиная с 1-го дня исследования, в то время как достоверный эффект солкосерила наблюдался к 14-му дню. К этому сроку произошло практически полное заживление ран в группах II и III. Динамика заживления ожогов была несколько замедлена по сравнению с ранозаживлением - практически полное заживление наблюдалось только к 24-му дню в группах II и III. Статистически достоверное улучшение при приеме оротата магния по сравнению с контролем наблюдалось начиная со 2-й нед. эксперимента. Солкосерил способствовал более эффективному заживлению ожогов (рис. 3), а Магнерот® - более эффективному заживлению ран (рис. 2).
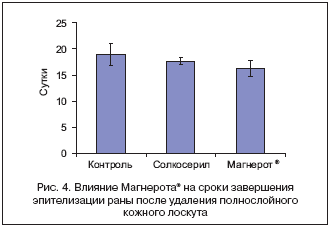
Различия в сроках завершения эпителизации на обеих моделях указаны на рисунке 4. Применение оротата магния достоверно сокращало сроки полного завершения эпителизации ран в среднем на 2,5±1,4 дня по сравнению с группой контроля и на 1,5±1,2 дня при сравнении со стандартной терапией солкосерилом. В случае моделей «Ожог» солкосерил способствовал сокращению времени эпителизации на 6,2±1,9 дня (р=0,0001), а оротат магния - на 1,8±1,6 дня (р=0,05).
Результаты гистоморфологического исследования рубцов
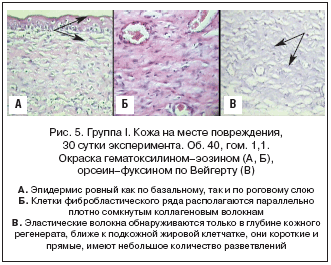
Группа I (модель «Рана», контроль). Эпидермис ровный как по верхнему слою, так и по нижнему. Роговой слой тонкий. Базальный слой кератиноцитов ровный, ядра клеток крупные, округлые, сами клетки слегка вытянуты. Большинство кератиноцитов вакуолизированы. Коллагеновые волокна, имеющие параллельную поверхности регенерата ориентацию, плотно прилегают друг к другу. Между коллагеновыми волокнами располагается множество фибробластов. В фиброзной ткани находится большое количество капилляров. Основное аморфное вещество выражено слабо. Эластические волокна обнаруживаются только в глубине кожного регенерата, ближе к подкожной жировой клетчатке, они короткие и прямые, имеют небольшое количество разветвлений. По всему объему рубца эластические волокна находятся ближе к неповрежденной коже. Микрофотографии рубцовой зоны у крыс группы I представлены на рисунке 5.
Группа II (модель «Рана», контроль - солкосерил). Эпидермис по базальному слою образует небольшое количество выпячиваний - зачатков волосяных фолликулов, а на его поверхности формируется сложный микрорельеф. Роговой слой толстый. Отдельные его клетки вакуолизированы. Базальные кератиноциты плотно сомкнуты между собой, имеют вытянутую форму, ядра четко очерчены. В фиброзной ткани коллагеновые волокна имеют небольшую извитость, фибробластов по сравнению с I группой меньше, хорошо развито микроциркуляторное русло. Эластические волокна сформированы по всему объему рубца ближе к краю регенерата и располагаются вдоль коллагеновых волокон, образуя очень тонкие, едва заметные ответвления. В центральной же части обнаруживаются лишь в отдельных полях зрения, где в виде коротких волокон прилегают к базальному слою эпидермиса, или обнаруживаются только на дне регенерата. Таким образом, при приеме солкосерила можно констатировать формирование более полноценного, чем в контроле, кожного регенерата. Это подтверждает правомерность использования солкосерила в качестве препарата сравнения.
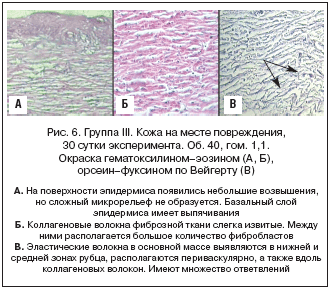
Группа III (модель «Рана», Магнерот®). На поверхности эпидермиса появились небольшие возвышения, но сложный микрорельеф не образуется. Базальный слой эпидермиса имеет выпячивания. Роговой слой толстый, легко отслаивается. Кератоциты вытянутые, тонкие, ядра овальные, вакуолизированы и плотно сомкнуты. Коллагеновые волокна фиброзной ткани слегка извитые. Между ними располагается большое количество фибробластов, но основного аморфного вещества немного. Капилляры многочисленны, находятся как в прилегающей к эпидермису зоне, так и в нижней части рубца. Эластические волокна в основной массе выявляются в нижней и средней зонах рубца, располагаются периваскулярно, а также вдоль коллагеновых волокон. Имеют множество ответвлений. В верхней области рубца встречаются единично по 1-2 в поле зрения, прямые, без ответвлений. Фотографии препаратов кожного регенерата этой группы показаны на рисунке 6.
Таким образом, прием оротата магния у моделей «Рана» соответствовал образованию более плотного слоя клеток при сравнении с контролем. Большее количество фибробластов соответствует более здоровому ранозаживлению и менее выраженному рубцу, на что также указывает отсутствие избыточных коллагеновых волокон.
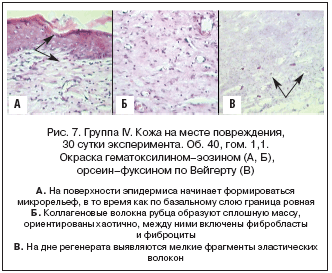
Группа IV (модель «Ожог», контроль). На 30 сут. после нанесения ожога на месте повреждения сформировалась зрелая фиброзная ткань. Эпидермис утолщен, все слои четко выражены, включают в себя 7-10 рядов клеток. Базальный слой представлен 2-3 рядами клеток с умеренно гиперхромными ядрами, имеющими одно ядрышко. Цитоплазма клеток шиповатого слоя вакуолизирована. Отмечается гиперкератоз. На поверхности эпидермиса начинает формироваться микрорельеф, в то время как по базальному слою граница ровная. Коллагеновые волокна рубца образуют сплошную массу, ориентированы хаотично, между ними включены фибробласты и фиброциты. Интенсивно развито микроциркуляторное русло, имеются открытые концы поперечно срезанных капилляров по 7-8 в поле зрения. Эластические волокна выявляются только на дне регенерата и в подкожно-жировой клетчатке в виде коротких и мелких фрагментов (рис. 7).
Группа V (модель «Ожог», контроль - солкосерил). Эпидермис так же утолщен, как и у крыс контрольной группы. Сформированы все слои клеток, расположенные в 7-9 рядов. Базальный слой эпидермиса образован 2 рядами клеток с четкими контурами и умеренно окрашенными ядрами. Роговой слой тонкий, выпячивания в верхних слоях эпидермиса более выражены, чем в нижних. Фиброзная ткань представлена коллагеновыми волокнами, ориентированными либо параллельно поверхности регенерата, либо беспорядочно. В ней преобладают фибробласты, основного аморфного вещества больше, чем в контрольной группе. Микроциркуляторное русло развито хорошо, продольно срезанные капилляры ориентированы перпендикулярно поверхности рубца. Просветов поперечно срезанных капилляров выявляется по 9-10 в поле зрения. Хорошо развита подкожная жировая клетчатка. Эластические волокна обнаруживаются на дне регенерата. Они многочисленные, но короткие, тонкие, с едва заметными ответвлениями.
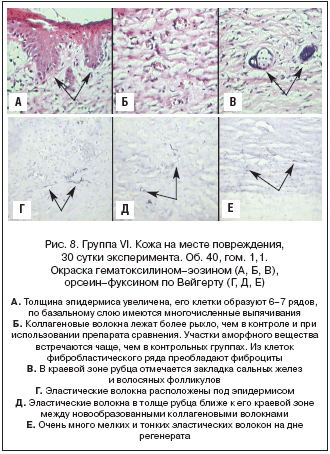
Группа VI (модель «Ожог», Магнерот®). Толщина эпидермиса увеличена, его клетки образуют 6-7 рядов, по базальному слою имеются многочисленные выпячивания. Клетки базального слоя вытянутые, их ядра мелкие, гиперхромные. Ядра клеток шиповатого слоя крупные, имеют 1-2 ядрышка, цитоплазма вакуолизирована. Роговой слой умеренно толстый, в некоторых участках легко отслаивается. Коллагеновые волокна лежат более рыхло, чем в контроле и при использовании препарата сравнения. Участки аморфного вещества встречаются чаще, чем в контрольных группах. Из клеток фибробластического ряда преобладают фиброциты. Просветов поперечно срезанных капилляров по 10-12 в поле зрения. Подкожная жировая клетчатка выражена слабо. В краевой зоне рубца отмечается закладка сальных желез и волосяных фолликулов. Эластические волокна расположены под эпидермисом, а также в толще рубца ближе к его краевой зоне между новообразованными коллагеновыми волокнами. Очень много мелких и тонких эластических волокон на дне регенерата. На рисунке 8 представлены фотографии, иллюстрирующие данное описание.
Таким образом, применение оротата магния при ожогах предотвращает избыточное разрастание коллагеновых фибрилл, способствует росту эластиновых волокон (придающих эластичность рубцу), увеличению числа фибробластов СТ и формированию аморфного вещества (полисахаридного геля). Эти эффекты, соответствующие предложенным ранее молекулярным механизмам воздействия магния на СТ [5], повышают качество рубца при ожогах.
Заключение
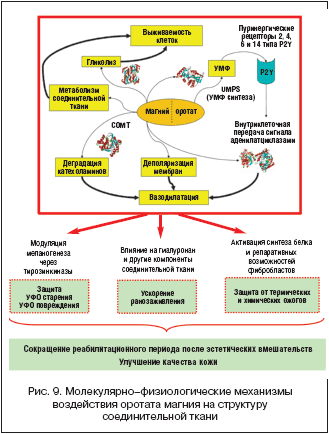
Качество ранозаживления влияет на исход оперативных вмешательств. Повышение качества и скорости заживления ран и ожогов важно для предотвращения осложнений. Усилия специалистов в области эстетической медицины, безукоризненное выполнение операций и аппаратных вмешательств могут быть сведены на нет из-за неполноценного ранозаживления в реабилитационный период. Магний является модулятором роста СТ и может способствовать улучшению процессов ранозаживления (рис. 9).
В настоящей работе было проведено экспериментальное исследование эффектов оротата магния на эпителизацию ран и ожогов. Применение Магнерота® позитивно отразилось на течении восстановительного процесса в коже. Склеротические изменения СТ в зоне повреждения у животных, получавших препарат, на 30-й день оказались выраженными в меньшей степени, чем в контрольной группе. В соответствии с измерениями площади эпителизации солкосерил способствовал более эффективному заживлению ожогов, в то время как препарат Магнерот® - более эффективному заживлению ран, более равномерному прокрашиванию вновь образовавшейся кожи, улучшению ее тургора. Применение оротата магния достоверно сокращало сроки полного завершения эпителизации ран, предотвращало избыточное разрастание коллагеновых фибрилл на фоне стимулирования роста эластиновых волокон, придающих эластичность рубцу, роста числа фибробластов СТ и формирования аморфного вещества. Эти эффекты способствуют повышению качества рубца при ожогах.

Литература
1. Бойчук Н.В., Исламов Р.Р., Кузнецов С.Л., Улумбеков Э.Г., Челышев Ю.А. Гистология, эмбриология, цитология. М.: Гэотар-Мед, 2007. 408 с.
2. Громова О.А. Магний и пиридоксин: основы знаний. М.: ПротоТип, 2006. 236 с.
3. Западнюк И.П., Западнюк В.И., Захария Е.А. Лабораторные животные. Киев: Вища школа, 1983.
4. Нечаева Г.И., Яковлев В.М., Громова О.А., Викторова И.А. с соавт. Дисплазии соединительной ткани у детей и подростков. М.: изд-во Союза педиатров России, 2009, 123 с.
5. Торшин И.Ю., Громова О.А. Возможные молекулярные механизмы воздействия магния на дисплазию соединительных тканей // РМЖ. 2008. № 4. С. 63-69.
6. Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005. С. 832.
7. Berger M.M., Rothen C., Cavadini C., Chiolero R.L. Exudative mineral losses after serious burns: a clue to the alterations of magnesium and phosphate metabolism // Am J Clin Nutr. 1997 May. Vol. 65 (5). Р. 1473-14781. PubMed PMID: 9129479.
8. Heidarianpour A., Sadeghian E., Gorzi A., Nazem F. The influence of oral magnesium sulfate on skin microvasculature blood flow in diabetic rats // Biol Trace Elem Res. 2011 Oct. Vol. 143 (1). Р. 344-350. Epub 2010 Sep 21. PubMed PMID: 20857343.
9. Kameyama K., Sakai C., Kondoh S., Yonemoto K., Nishiyama S., Tagawa M., Murata T., Ohnuma T., Quigley J., Dorsky A., Bucks D., Blanock K. Inhibitory effect of magnesium L-ascorbyl-2-phosphate (VC-PMG) on melanogenesis in vitro and in vivo // J Am Acad Dermatol. 1996 Jan. Vol. 34 (1). Р. 29-33. PubMed PMID: 8543691.
10. Kobayashi S., Takehana M., Itoh S., Ogata E. Protective effect of magnesium-L-ascorbyl-2 phosphate against skin damage induced by UVB irradiation // Photochem Photobiol. 1996 Jul. Vol. 64 (1). 224-228. PubMed PMID: 8787018.
11. Silva G.M., Maia Campos P.M. Histopathological, morphometric and stereological studies of ascorbic acid and magnesium ascorbyl phosphate in a skin care formulation // Int J Cosmet Sci. 2000 Jun. Vol. 22 (3). Р. 169-179. PubMed PMID: 18503473.
12. Torshin I.Yu., Gromova O.A. Magnesium and pyridoxine: fundamental studies and clinical practice // Nova Science, NY, 2009. ISBN-10: 1-60741-704-9.
13. Williams J.M., Hammad A., Cottington E.C., Harchelroad F.C. Intravenous magnesium in the treatment of hydrofluoric acid burns in rats // Ann Emerg Med. 1994 Mar. Vol. 23 (3). Р. 464-469. PubMed PMID: 8135420.

