
|
|
 |
|||||||||
| |||||||||
|
ПЕПТИД ДЕЛЬТА-СНА: НАШ ПУТЬ ОТ МИФИЧЕСКОГО ФАКТОРА СНА К ЭФФЕКТИВНОМУ ЛЕКАРСТВЕННОМУ ПРЕПАРАТУ ДЕЛЬТАРАН
(Доклад, представленный на VI чтениях, посвященных памяти академика Ю.А. Овчинникова, Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 25 ноября -2 декабря 2002 года) Михалева И.И., Прудченко И.А., Иванов В.Т., Войтенков Б.О. Институт биоорганической химии им. М.М. Шемякина-Ю.А. Овчинникова РАН, Москва; "Исследовательский центр Комкон", Санкт-Петербург В ИБХ им. М.М. Шемякина - Ю.А. Овчинникова РАН в лаборатории химии пептидов в течение многих лет проводится химико-биологическое изучение одного из регуляторных пептидов, а именно пептида дельта-сна.
Мне бы хотелось кратко остановиться на отдельных результатах фундаментальных и практических работ в этой области. В качестве введения несколько слов об истории этого пептида. Пептид дельта-сна известен с конца 70-тых годов, но до сих пор остается недостаточно изученным. Его история началась в 1977 году после сообщения швейцарских ученых М. Монье и Г. Шоненбергера о выделении фактора пептидной природы WAGGDASGE из церебральной венозной крови кроликов, подвергнутых низкочастотной гипногенной электростимуляции таламуса (Рис.1).  Этот фактор вызывал у кроликов увеличение представленности медленно-волнового сна в электроэнцефалограмме, именно с этим и связано его название - пептид дельта-сна (DSIP, delta sleep-inducing peptide). Вскоре после опубликования структуры пептида проявился большой интерес к нему как к гуморальному фактору сна. Были проведены исследования его сомногенной активности уже на синтетическом пептиде в надежде выйти к физиологичным снотворным на базе эндогенного фактора. Сомнительность сомногенных свойств пептида и разочарование в надеждах быстро получить на его основе эффективный снотворный препарат, хотя и вызвало определенный скептицизм, тем не менее, явилось стимулом для его более широкого изучения. И в результате появились данные о наличии у него и многих других эффектов, не имеющих прямого отношения ко сну: о влиянии на двигательную активность, терморегуляцию и циркадные ритмы, о налоксон-чувствительной анальгезии, о воздействии на концентрацию нейромедиаторов в мозге и о стресс-протективных свойствах. ДСИП проявлял себя как полифункциональный нейропептид. Дальнейшие исследования выявили большой спектр психофармакологических свойств этого пептида, который можно уверенно отнести сегодня к типичным нейромодуляторам, проявляющим полифункциональное и пролонгированное действие на организм. В связи с отсутствием четких представлений о биологической функции пептида дельта-сна на момент начала наших исследований мы сочли необходимым совместно с рядом медико-биологических учреждений провести цикл исследований в направлении изучения биологических свойств нативного пептида в широком наборе тестов. В ходе этих исследований получены убедительные данные о том, что для пептида дельта-сна наиболее выражена адаптогенная и стресс-протективная активность. Системное введение пептида в малых дозах вызывает существенное улучшение различных физиологических и метаболических показателей, нарушаемых под воздействием различных стрессовых факторов Рис 2) 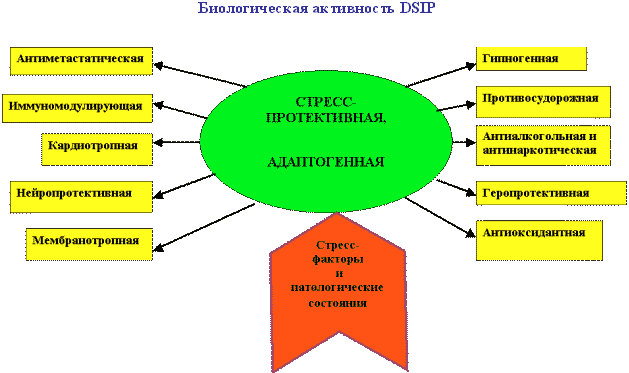 Были проведены многочисленные исследования влияния пептида дельта-сна на животных in vivo в условиях воздействия на организм различных по природе и силе стрессовых факторов (таких как гипоксия и гипероксия, гипокинезия и холод, и применение разных эпилептогенов, экспериментальный алкоголизм и наркомания, инокуляция опухолевых клеток, метастазирующие опухоли и др.). Эти исследования выявили уникальную способность пептида существенно ограничивать или предотвращать вызываемые стрессовыми факторами губительные метаболические сдвиги. Пептид проявлял себя как очень эффективный стресс-нормализующий фактор, который способствовал удержанию физиологических процессов в организме в пределах естественной адаптации и препятствовал их патологическим срывам, приводящим к нарушению функций жизненно важных систем организма (кардио - и нейропротективный эффект, антиметастатическое и противосудорожное действие и др.). Какие конкретно биологические эффекты наблюдались при исследовании активности пептида в различных экспериментальных моделях в случае каждого из приведенных видов активности, можно увидеть на следующей таблице (сл. 3). 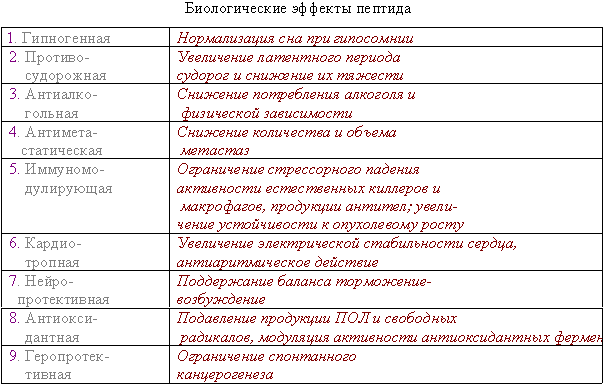 Так, гипногенная активность наиболее четко выявлялась как нормализация сна в случае его дефицита и не проявлялась в норме, когда сон не был нарушен. Установлено также, что пептид проявляет достоверную антиалкогольную и антинаркотическую активность. Далее несколько слов об антиэпилептических свойствах соединений. ДСИП проявляет противосудорожное действие: подавляет эпилептические очаги в коре, создаваемые аппликацией различных эпилептогенов. Совместное применение пептида и ряда противосудорожных препаратов (реланиум, фенобарбитал, карбамазепин и др.) потенцирует их действие и позволяет снижать их дозу. Механизм антисудорожной активности пептида связан, скорее всего, с его способностью уменьшать повышенное возбуждение мозга, возникающее при экспериментальном эпилептическом синдроме. Одной из пионерских работ в области исследования стресс-протективных свойств DSIP было изучение влияния пептида на устойчивость животных в условиях острого эмоционального стресса, проведенное К.В. Судаковым и сотр. DSIP достоверно подавлял сердечно-сосудистые нарушения в условиях острого эмоционального стресса и увеличивал выживаемость животных, при этом предварительное введение пептида оказывало выраженное профилактирующее действие и увеличивало количество устойчивых к стрессу животных с более адекватной реакцией со стороны кардиоваскулярной системы на острые стрессовые факторы. В серии экспериментов, проведенных Ульянинским Л.С., М. Звягинцевой и др. на кроликах в условиях нембуталового наркоза, показано, что пептид при внутривенном введении 60 нмоль/кг достоверно повышает электрическую стабильность сердца кролика, значительно (40-50%) повышая пороги возникновения желудочковой фибрилляции и ее предшественников. В условиях же дефицита пептида при введении соответствующей антисыворотки, наоборот, происходило снижение порога наступления желудочковой аритмии. Выраженное антиаритмическое действие пептида авторы-физиологи связывали не только с его центральным антистрессорным действием и влиянием на экстракардиальную регуляцию, но и с увеличением электрической стабильности сердца. Приведенные в этой таблице эффекты пептида, в основном, уже хорошо известны из опубликованных ранее работ. А на последней строчке таблицы я задержусь и расскажу подробнее. В НИИ онкологии им. Петрова В С.-Петербурге было проведено исследование влияния пептида на спонтанный канцерогенез и продолжительность жизни мышей в условиях пожизненного введения пептида (уже в виде разработанной нами его лекарственной формы - дельтарана). Дельтарано (DSIP -глицин 1:10 по весу) вводился подкожно в дозе 100мкг/кг самкам мышей линии SHR, начиная с 3-месячного возраста, однократно в течение последовательных 5 дней каждого месяца на протяжении всей их жизни. Контрольным животным в аналогичных условиях вводили физиологический раствор. Оценивали изменение массы животных, потребления корма, среднюю и максимальную продолжительность жизни, спонтанное опухолеобразование и проводили классификацию опухолей согласно рекомендациям Международного агентства по изучению рака. Анализ полученных результатов (сл. 4) позволяет заключить, что применение дельтарана оказывает угнетающее влияние на спонтанный канцерогенез у мышей SHR, что выразилось в снижении частоты развития всех опухолей (в 2,1 раза), злокачественных новообразований (в 2,4 раза), множественности развития опухолей (в 1,5 раза). Под влиянием дельтарана у мышей в 5 раз реже развивались аденокарциномы молочной железы и в 6 раз - лейкозы. Аденокарциномы молочной железы в 7 раз реже метастазировали в легкие по сравнению с новообразованиями этой локализации в контрольной группе.  Кривая возникновения опухолей (рис.5) в группе, получавшей дельтаран, была существенно сдвинута вправо по сравнению с контролем.  При анализе динамики выживаемости выяснилось, что до 24-месячного возраста гибель мышей в обеих группах происходила примерно с одинаковой скоростью. Однако в дальнейшем скорость вымирания животных, получавших дельтаран, резко замедлялась. В результате уже через 24 мес. в этой группе в живых оставалось 5 мышей, тогда как в контроле - лишь 2. К 25 мес. все контрольные мыши контрольной группы пали, тогда как животные, получавшие дельтаран, еще длительное время были живы. Средняя продолжительность жизни (СПЖ) (см. сл. 4) мышей под влиянием введений дельтарана по сравнению с контролем не изменилась, однако на 19 % увеличилась СПЖ последних 10 % животных (p < 0,05). Максимальная продолжительность жизни мышей, получавших дельтаран, была больше, чем в контроле, на 6 месяцев. Влияние дельтарана на продолжительность жизни и способность сдерживать спонтанный канцерогенез хорошо коррелируют с установленным в ходе этого эксперимента фактом достоверного снижения количества хромосомных аберраций (22,6%) в клетках костного мозга мышей. В этом эксперименте было также установлено, что введение дельтарана ограничивало типичное для стареющих животных удлинение эстрального цикла. Эти данные свидетельствует о том, что дельтаран обладает выраженным геропротекторным эффектом. Важно также подчеркнуть, что в этом почти 3-летнем эксперименте была подтверждена полная биобезопасность препарата. В течение ряда лет мы пытались исследовать биохимические процессы, лежащие в основе антистрессорного и адаптогенного действия пептида дельта-сна. (сл.6). 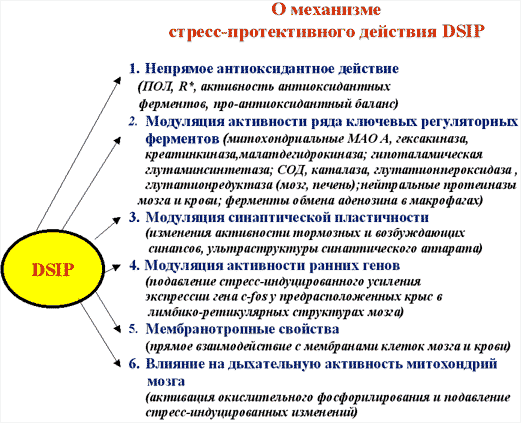 Совместно с Г.Т. Рихиревой и сотр. (Институт химической физики им. Н.Н. Семенова РАН), а также с группой А.М. Менджерицкого (Ростовский государственный университет) на модели гипокинетического стресса проводили поиск чувствительных параметров пост-стрессорных изменений в тканях животного. В результате исследования было показано, что сам ДСИП не обладает прямой антирадикальной активностью, но проявляет свойства непрямого антиоксиданта, влияя на концентрацию конечного продукта перекисного окисления липидов - малонового диальдегида (МДА) в тканях мозга. Показано существование положительной корреляции между глубиной стрессового воздействия и концентрацией МДА в тканях мозга. Установлено также, что антиоксидантное действие является следствием воздействия на первичные стресс-индуцируемые процессы и сопряжено с активацией клеточных антиоксидантных ферментов из семейства СОД. Так как перекисное окисление липидов является по современным представлениям обязательной компонентой стресс-реакции в организме, то антиоксидантное действие DSIP, видимо, является важной составной частью механизма реализации антистрессового эффекта этого пептида. Внутриклеточный окислительно-восстановительный баланс жестко контролируется в различных типах клеток и его нарушение имеет серьезные последствия для клеток вследствие происходящей модуляции экспрессии генов и последующих метаболических изменений]. Способность пептида уменьшать вызываемое стрессом чрезмерное накопление активных форм кислорода ведет к ограничению деструктивных последствий хронического или острого стресса. компонентой стресс-реакции в организме, то антиоксидантное действие ДСИП можно считать составной частью механизма его антистрессорного эффекта. В этой же работе показано ингибирующее действие ДСИП на процесс накопления свободных радикалов в гипоталамусе крыс при гипоксии. В серии работ (Бондаренко Т.И. и сотр.) показано, что предварительное введение пептида ускоряет адаптацию животных к холодовому стрессу и предотвращает или уменьшает неблагоприятные метаболические сдвиги, вызванные воздействием холода. Установлено, что пептид существенно увеличивает емкость антиоксидантной системы, включающей в себя ферментативные и неферментативные компоненты. Предварительное введение пептида перед помещением животных в холодовую камеру (+2 С) существенно увеличивало активность СОД и каталазы в мозге крыс, глутатионпероксидазы и глутатионредуктазы на 93 и 38% в мозге и на 65% в печени, при этом увеличивалась и концентрация восстановленного глутатиона в мозге и печени на 17 и 30%, соответственно, по сравнению с холодовым стрессом. Практически все показатели достигали контрольных значений, а активность глутатионредуктазы даже превышала уровень контроля на 23%, что можно рассматривать как адаптивную реакцию. Следует отметить, что разнообразные "нормализующие" свойства пептида проявляются в его способности модулировать активность ряда мембрано-ссоциированных ключевых ферментов, контролирующих метаболизм в мозге и периферических тканях. DSIP влияет на активность митохондриальных ферментов (моноаминооксидазы А, гексокиназы, НАД-зависимой малатдегидрогеназы, креатинкиназы и суммарных ферментов дыхательной цепи), гипоталамической глутаминсинтетазы, супероксиддисмутазы печени крыс и мембранных ферментов обмена аденозина в перитонеальных макрофагах крыс. Так, в качестве примера немного о моноаминооксидазе А (МАО А). Для МАО А, локализованной исключительно на внешней мембране митохондрий и являющейся важнейшим ферментом, ответственным за метаболизм биогенных аминов, было показано, что в норме ее активность не обнаруживается в цитоплазматической фракции. Ее активность проявляется лишь во фракции митохондриальных мембран, выделенных из гомогената мозга. Однако при стрессе она распределяется поровну между цитоплазматической и мембранной фракциями. Пептид в существенной степени ограничивает выход фермента в цитоплазму, скорее всего, благодаря уменьшению степени перекисного окисления липидов и предупреждению ослабления связи фермента с мембраной. В ходе изучения биохимических механизмов действия пептида было установлено отчетливое воздействие пептида на интенсивность протеолитических процессов в мозге и крови. Показано долговременное и значительное влияние нейропептида на активность протеолитических ферментов сыворотки крови и мозга крыс и устойчивость лизосомальных мембран в условиях стресса. Это модулирующее воздействие пептида было направлено на компенсацию стресс-индуцированных изменений и на предотвращение патологических деструктивных отклонений в интенсивности протеолитических процессов, играющих важную роль в метаболизме. С помощью компьютерной морфометрии было показано, что адаптивные свойства ДСИП реализуются также посредством модулирующего воздействия на механизмы синаптической пластичности. Пластические перестройки в нейронах неокортекса выражаются в дифференцированных изменениях ультраструктуры синаптического аппарата, а именно: активации тормозных аксосоматических и подавлении возбуждающих аксошипиковых синапсов. С помощью электронной микроскопии на тонких срезах сенсомоторной коры головного мозга крыс были получены данные о регуляторном участии ДСИП в явлениях пластичности ЦНС. В зависимости от физиологического статуса организма ДСИП оказывал различное регулирующее влияние на активность возбуждающих и тормозных синапсов, результатом которого являлась защита от повреждающего воздействия стрессовых факторов или создание состояния неспецифической преадаптации, которое характерно для начальных этапов стресса. Это состояние характеризовалось соответствующими морфометрическими изменениями тормозных аксосоматических и аксошипиковых синапсов, приводившими к ограничению патологических сдвигов в балансе их тормозной и возбуждающей активности. Полученные в ходе проведенных исследований данные позволяют полагать, что модуляторное действие пептида связано с молекулярными механизмами синаптической пластичности. Далее немного о предпринятом изучении молекулярных механизмов действия ДСИП. С использованием метода спиновых меток и зондов впервые выявлено наличие прямого взаимодействия пептида с клеточными мембранными структурами in vitro. Критерием динамического состояния липидных компонентов различных областей мембраны рассматривали параметр упорядоченности S, который характеризует молекулярную подвижность зонда и рассчитывается по спектрам ЭПР (сл.7). 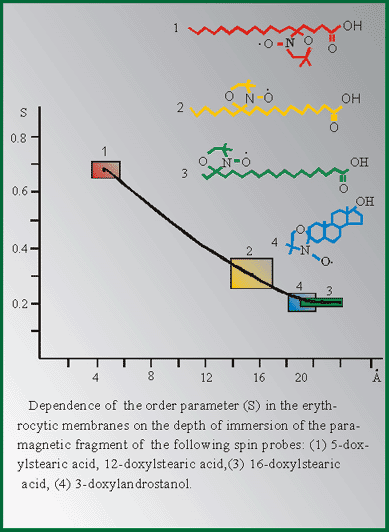 Использование парамагнитных зондов 5-, 12- и 16-доксилстеариновых кислот и 3-доксиландростанола разной гидрофобности и с разной локализацией в мембране показало, что введение DSIP в суспензию эритроцитов вызывает отчетливое увеличение подвижности гидрофобной области мембранного бислоя (сл. 8) 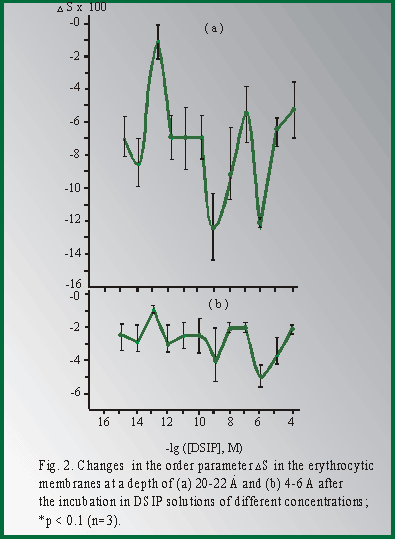 как на глубине порядка 20-22 A, так и более полярной области приповерхностного слоя (4-6 A). Установлено, что зависимость наблюдаемых эффектов от концентрации имеет выраженный экстремальный характер. Максимальное увеличение подвижности липидов мембраны регистрировали при концентрациях пептида 10-9 и 10-6 М. Полученные в опытах in vitro результаты показали, что DSIP оказывает отчетливое влияние на динамические параметры плазматических мембран, изменяя физико-химическое состояние их липидных компонентов. Сходные результаты были получены также и на синаптосомальных мембранах мозга мыши. Изменение динамических параметров проявлялось более четко в приповерхностной зоне в области белок-липидных взаимодействий. Эти взаимодействия, как известно, играют существенную роль в осуществлении регуляторных функций биологической мембраны. Наибольшие изменения динамических свойств мембраны эритроцитов были найдены при концентрации DSIP 10-6 М. Проведено также подобное исследование взаимодействия пептида дельта-сна с мембранами тромбоцитов из донорской крови человека. Установлено, что пептид, также как и при взаимодействии с мембранами эритроцитов, вызывает достоверное снижение параметра упорядоченности S (сл. 9)  во всем тестируемом интервале концентраций: 10-15 - 10 -4 М Наибольшее уменьшение жесткости мембраны (?S) при концентрации пептида 5 10-9 М регистрировали на глубине 20-22 A в гидрофобной области бислоя ( глубинный зонд, 16-доксилстеариновая кислота). Кстати, биологически неактивный аналог пептида TrpAspAlaSerGlyGlu не проявлял типичных для пептида дельта-сна эффектов на мембранах эритроцитов ни в глубинной, ни в приповерхностной зоне мембраны (сл. 10), что свидетельствует в пользу возможной связи мембранотропных свойств пептида и механизма реализации его биологической активности. 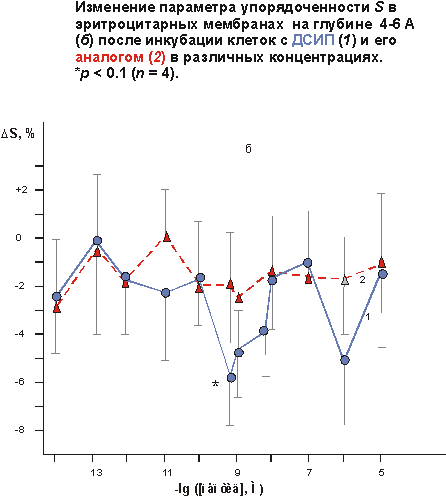 Таким образом, мембранотропное действие DSIP, которое резонно можно было предполагать для этого пептида на основе анализа его многочисленных биологических эффектов, подтверждается серией проведенных и выше упомянутых экспериментов по изучению взаимодействия пептида с биологическими мембранами с помощью спиновых методов и меток in vitro. В ходе изучения биохимических механизмов действия пептида дельта-сна, нами совместно с Е.М. Хватовой (Нижегородская медицинская академия) были предприняты исследования возможного влияния пептида на активность дыхательной цепи и эффективность окислительного фосфорилирования на митохондриальных препаратах из мозга крыс. Мы принимали во внимание, что именно митохондрия является основным продуцентом активных форм кислорода в физиологических условиях и, в еще большей степени, при патологиях. Митохондрия является также важной мишенью серьезных стрессовых повреждений, могущих привести в итоге к клеточной гибели из-за активации протекания апоптоза и некроза. Было найдено (сл.11), что DSIP, а также медицинский препарат дельтаран значительно увеличивали эффективность окислительного фосфорилирования.  Пептид достоверно повышал скорость фосфорилирующего дыхания V3, не изменяя при этом скорость разобщенного дыхания VDNP, повышал дыхательный контроль и скорость фосфорилирования ADP. Интересно отметить, что пептид полностью подавлял вызванное экспериментальной гипоксией уменьшение V3 и ADP/t при условии его предварительного введения внутрибрюшинно в дозе 120 mг/кг крысам, подвергаемым гипоксии (сл.12).  Стресс-протективное и адаптогенное действие пептида дельта-сна четко проявлялось вне зависимости от вида стрессового или иного патологического воздействия. Можно однозначно утверждать, что пептид дельта-сна проявляет свойства эндогенного фактора, ограничивающего или даже предотвращающего стресс-индуцируемые патологические нарушения, способствуя удержанию биохимических и физиологических процессов в рамках адаптивных норм. Можно полагать, что этот необычный мембрано-активный нейропептид является как бы природным адаптогеном и модулирует центральные регуляторные процессы, ограничивая их патологический срыв при действии различных возмущающих факторов как внешних, так и внутренних, проявляя большую эффективность при усилении их возмущающего действия и часто не вмешиваясь в отсутствие таких отклонений от нормы. Сегодня не представляется возможным сделать какие-либо однозначные выводы о первичных и прямых мишенях этого пептида на клеточном уровне. Однако, на основе анализа имеющихся данных о действии пептида, можно предположить, что непосредственной мишенью пептида являются клеточные мембраны. Надо полагать, что речь идет как о наружных, так и о внутренних мембранах различных клеток, например клеток мозга, крови, печени и др. Модулирующее влияние пептида, вероятно, осуществляется посредством влияния на общие и универсальные регуляторные механизмы клетки с участием клеточных мембран. Как уже отмечалось выше, с помощью ряда биохимических и биофизических экспериментов четко показано ингибирующее и превентивное действие пептида дельта-сна на интенсивность перекисного окисления липидов различных видов биологических мембран, например, таких как синаптосомальные, митохондриальные, эритроцитарные. Обнаружено также вызываемое пептидом значительное уменьшение стресс-индуцированного накопления свободных радикалов в мозге. Антиоксидантная активность пептида заслуживает особого внимания и, скорее всего, имеет самое непосредственное отношение к пониманию широты спектра проявляемых пептидом физиологических эффектов. В последние годы резко обозначился большой интерес к исследованиям роли про-и антиоксидантного равновесия в организме, показана патогенетическая роль нарушений его хрупкого баланса для многих нейродегенеративных, онкологических, метаболических и других заболеваний и патологических состояний. Окислительный стресс определяют сегодня как нарушение про-и антиоксидантного равновесия, ведущего к гибели клеток путем апоптоза или некроза вследствие повреждения активными формами кислорода и азота практически всех важных макромолекул, включая нуклеиновые кислоты, белки, карбогидраты и липиды. Триггерная и модуляторная роль окислительного стресса в апоптозе клеток уже не вызывает сомнений. Проведенные исследования биологической активности ДСИП и механизма его действия стали основой понимания широты фармакологического потенциала пептида и перспективности его применения в медицине. В заключение следует упомянуть еще об одной важной части наших усилий по изучению пептида дельта-сна, связанной с медицинскими аспектами. Завершена многолетняя работа по созданию лекарственного препарата на основе пептида - дельтарана. Дельтаран разрешен к медицинскому применению и зарегистрирован в России как лекарственный препарат. Заключительные слайды (13-15) хорошо иллюстрируют высокую эффективность препарата Дельтаран в клинике при различных стресс-индуцированных патологиях и нарушениях адаптации. 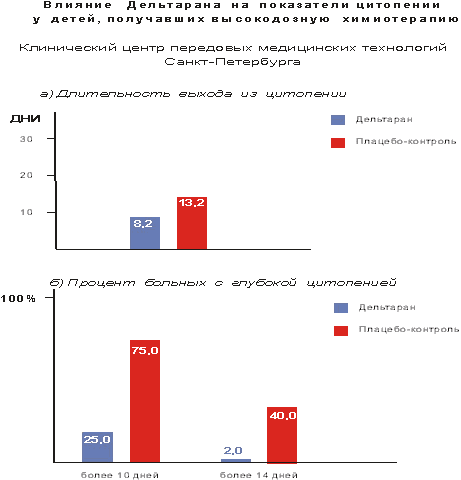
Список литературы по теме доклада
|
Дизайн и поддержка: Interface Ltd. |
|