|
|
Иммунотропные эффекты гиалуроновой кислоты в дерматологии
Н.П. Михайлова, И.В. Кочурова, В.В. Базарный
В течение двух последних десятилетий был достигнут значительный прогресс в понимании роли гиалуроновой кислоты (ГК) в регуляции физиологических и патологических состояний, определены механизмы ее синтеза и деградации. В настоящее время изучается значение ГК в ангиогенезе, развитии злокачественных новообразований и болезней суставов, легких, кожи, а также ее участие в иммунорегуляции. ГК традиционно не рассматривалась как иммуномодулятор. Однако накопленные в последнее время данные свидетельствуют о том, что она играет важную роль в иммунной системе кожи.
Н. П. Михайлова
врач-дерматолог, косметолог, член Американской академии дерматологов (AAD), сертифицированный тренер компании «Bioscientific Trading LTD» (Франция), главный врач клиники «Реформа», г. Москва
И. В. Кочурова
врач-дерматолог, косметолог, онколог, врач-методист направления «Контурная пластика и мезотерапия» УМЦ «Мартинекс», г. Москва
В. В. Базарный
доктор медицинских наук, профессор кафедры клинической лабораторной диагностики и бактериологии, главный научный сотрудник Центральной научно-исследовательской лаборатории Уральской государственной медицинской академии, г. Екатеринбург
Актуальность проблемы
Кожа является одним из самых крупных органов человека. Она непосредственно контактирует с внешней средой и постоянно испытывает антигенную нагрузку, выполняя роль органа иммуногенеза [5]. Это доказывается, в частности, тем, что в дерме присутствуют иммунокомпетентные клетки и медиаторы как естественного, так и адаптивного иммунитета [6, 15, 17]. Неслучайно в последние десятилетия сформировалость представление об иммунной системе кожи - SALT, которой посвящен ряд современных обзоров [ 1, 5, 6, 15, 16].
Нарушения иммунной системы кожи лежат в основе иммунопатогенеза некоторых заболеваний - псориаза, атопического дерматита, угревой болезни, лимфом кожи и других [13, 14, 16, 20, 49]. Поэтому изучение иммунологических механизмов регуляции функций кожи в норме и патологии, а также коррекция иммунопатологических механизмов при заболеваниях кожи и оптимизация в ней восстановительных процессов остаются актуальной научной и клинической задачей. Для ее решения предложен целый ряд иммуномодуляторов: левамизол, цитомедины, цитокины, Гепон, рекомбинантные интерфероны (Реаферон, Интрон -А) [9, 10]. Однако их эффективность не всегда высока, а результаты применения иногда противоречивы и неоднозначны. Встречаются и побочные эффекты. Для снижения системных осложнений иммуномодулирующей терапии перспективным представляется локальное интрадермальное введение иммуномодуляторов. В частности, в исследованиях Базарного и соавт. [2] было показано, что внутрикожные иньекции Рибомунила оказывают не только иммунотропный эффект, но и активизирует репаративные процессы в коже. Однако другие доказательства эффективности иммуномодуляторов при их внутрикожном применении практически отсутствуют.
В этой связи интересна иммунологическая роль гиалуроновой кислоты - как основного компонента межклеточного матрикса кожи - в регуляции воспаления, регенерации, в обеспечении иммунологической толерантности и иммуномодуляции.
Развитие представлений о роли гиалуроновой кислоты в организме и в коже
В течение двух последних десятилетий был достигнут значительный прогресс в понимании роли гиалуроновой кислоты (ГК) в регуляции как физиологичеких, так и патологических состояний, определены механизмы ее синтеза и деградации. В настоящее время ведутся многочисленные научные исследования, посвященные роли ГК в ангиогенезе, в развитии злокачественных новообразований, болезней суставов, легких и кожи, а также изучается участие ГК в иммунной регуляции различных физиологических и патологических состояний.
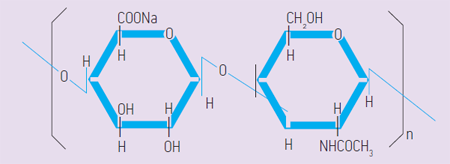
Гиалуроновая кислота - несульфатированный гликозаминогликан, неразветвленный полисахарид, состоящий из дисахаридных единиц, образованных N -ацетил- D -глюкозамином и D -глюкуроновой кислотой, которые соединены между собой b -1,3- и b -1,4-гликозидными связями (рис. 1).
У человека ГК содержится в различных тканях в виде натриевой соли (гиалуроната натрия), являясь одним из основных компонентов экстрацеллюлярного матрикса (ЭЦМ), стекловидного тела глаза и синовиальной жидкости. Наличие гиалуроновой кислоты в коже было впервые продемонстрировано Мейером в1948 г. [39].За период, прошедший со времени открытия ГК в1934 г., произошел переход от первоначальной точки зрения, согласно которой ГК считали пассивным структурным компонентом ЭЦМ, обеспечивающим, в частности, непроницаемость кожных покровов для микробов и токсинов, к признанию того факта, что эта широко распространенная макромолекула динамически включается во многие биологические процессы - от модуляции клеточной миграции и дифференцировки во время эмбриогенеза до регуляции метаболизма ЭЦМ и важной роли в заживлении ран, воспалении и метастазировании [8, 22]. Благодаря своим свойствам ГК находит применение в клинической практике. Она входит в состав препаратов с дезинфицируюшим, противовоспалительным и ранозаживляющим действием. Вместе с тем ГК участвует в процессах роста и регенерации, уменьшает проницаемость барьерных тканей, предотвращает образование грануляционной ткани и рубцов.
 Иммуннотропные свойства различных фракций гиалуроновой кислоты Иммуннотропные свойства различных фракций гиалуроновой кислоты
Известно, что биологические свойства (в том числе - иммунная активность) ГК меняются в зависимости от ее молекулярного веса. Низкомолекулярные фрагменты ГК, образующиеся при воспалении и повреждении тканей под действием бактериальных гиалуронидаз и свободных радикалов, обладают провоспалительными и иммунностимулирующими свойствами [28, 30]. Тетра- и олигосахара ГК в месте повреждения связываются с рецепторами CD44, RHAMM, LYVE-1, TLR2 и TLR4, расположенными на поверхности различных иммунокомпетентных клеток (моноцитов, Т-лимфоцитов, макрофагов и других), что приводит к внутриклеточной индукции синтеза провоспалительных цитокинов (макрофагальных воспалительных белков: МВБ-1a и МВБ-1b; белка хемотаксиса моноцитов 1; интерлейкинов: ИЛ-8, ИЛ-12, ИЛ-1b; фактора некроза опухолей: ФНО-a) и развитию каскада воспалительных реакций [32]. Термеер и соавт. [45] показали, что тетра-и гексасахара ГК обладают иммуностимулирующей активностью и вызывают иммунофенотипическое созревание моноцитарных дендритных антигенпрезентирующих клеток кожи. В другом исследовании Гольдштейн и соавт. [47] показали, что фрагменты ГК с молекулярной массой 135 кДа вызывают созревание дендритных клеток и стимулируют развитие аллоиммунитета, например, при трансплантации органов. Малые фрагменты ГК (тетра-и гексасахара) приводят к увеличению размеров дендритных клеток и увеличивают продукцию ими цитокинов ИЛ-1b, ФНО и ИЛ-12 [46].
В то же время высокомолекулярная гиалуроновая кислота является противовоспалительным агентом, приводит к снижению уровня провоспалительных цитокинов и играет активную роль в поддержании иммунной толерантности [24], способствует индукции регуляторных Т-клеток [25], подавляет фагоцитарную активность моноцитов [31] и реакцию антиген-антитело [29], препятствует активации лимфоцитов[27].
Гиалуронансвязывающие белки
Помимо молекулярной массы на проявление иммунотропных эффектов ГК влияет уровень экспрессии рецепторов ГК (гиалуронансвязывающих белков) на мембранах различных иммунокомпетентных клеток, фибробластов, кератиноцитов, эндотелиальных клеток.
Большая часть ГК существует в межклеточном матриксе в свободной растворимой форме. Другая часть ГК ковалентно связывается с различными белками [48]. Гиалуронансвязывающие белки, или гиаладгерины, могут быть разделены на несколько типов:
- Белки, которые связывают ГК с другими молекулами внеклеточного матрикса, например агрекан и версикан. Связываясь с ними, ГК формирует структуру разных видов соединительной ткани.
- Белки, которые действуют как клеточные рецепторы ГК, например CD44, RHAMM, TNFIP6, SHAP, LYVE-1 и другие.
CD44
CD44 - основной рецептор ГК на поверхности клетки. Он существует в виде нескольких изоформ: CD44s (стандартная), CD44e (эпителиальная) и CD44v (вариабельная) [26] и экспрессируется различными типами клеток: Т- и В- лимфоцитами, моноцитами, макрофагами, гранулоцитами, фибробластами, эпителиальными клетками и клетками головного мозга, эритроцитами, кератиноцитами, эндотелиальными клетками. Специфическое взаимодействие молекулы ГК и ее фрагментов с рецептором запускает ряд клеточных процессов, в частности - продукцию различных регуляторных молекул, прежде всего - цитокинов, что является важным компонентом иммунных реакций [37]. Установлено, что CD44 участвует также в фагоцитозе [41], принимает участие в хоуминге лимфоцитов [19]. Хейнс и соавт. высказали интересное предположение, что уровень гиалуронансвязывающих белков коррелирует с активностью воспалительного процесса, а введение анти-CD44-антител уменьшает лейкоцитарную инфильтрацию и отек тканей [33, 40].
RHAMM
Еще одним гиалуронансвязывающим белком, выделенным позднее, оказался гиаладгерин (RHAMM) - функциональный рецептор, найденный как на поверхности, так и в цитозоле и ядре различных клеток, в том числе эндотелиальных. Взаимодействия RHAMM и ГК играют важную роль в механизмах воспаления и иммуногенеза благодаря регуляции межклеточных взаимодействий. Введение экспериментальным животным анти-RHAMM-антител приводит к снижению активности воспалительного процесса [52].
Рецепторы TLR2 и TLR4
Toll-подобные рецепторы (TLR), в частности TLR2 и TLR4, экспрессируются моноцитами, дендритными клетками и лимфоцитами и связывают ГК. В то время как низкомолекулярные фрагменты ГК, связываясь с рецепторами TLR2 и TLR4, воказывают провоспалительное действие, высокомолекулярные фрагменты ГК ингибируют воспаление путем подавления TLR2- и TLR4-сигнализации [43].
TNFIP6
TNFIP6 (ФНО-индуцированный белок 6), кодируемый геном TSG-6, также является рецептором ГК. Он встречается во многих типах клеток и экспрессируется в ответ на провоспалительные цитокины (ИЛ-1 и ФНО) [36]. TNFIP6 - это противовоспалительный белок, который синтезируется при воспалении в условиях достаточной концентрации ГК.
Данный белок активен в кислой среде и обнаруживается в очаге воспаления, где является мощным ингибитором миграции нейтрофилов при развитии острого воспаления [23, 50].
LYVE-1
LYVE-1 (рецептор гиалуронана 1 эндотелия лимфатических сосудов) - это гликопротеин, гомолог рецептора CD44. Он связывает растворимую и иммобилизованную ГК [21] на мембране макрофагов, эндотелиальных клеток лимфатических сосудов и в ретикулярных клетках лимфатических узлов [51]. LYVE-1 участвует в миграции иммунокомпетентных клеток в лимфатические сосуды и лимфатические узлы [34, 35].
SHAP
SHAP - сывороточный протеин, связывающий гиалуроновую кислоту. Его повышенный уровень в сыворотке служит маркером, который напрямую коррелирует со степенью воспаления пр различных патологиях [44].
Таким образом, проявление иммунотропных эффектов ГК зависит не только от ее молекулярной массы, но и от уровня экспрессии гиалуронансвязывающих белков и функции иммунокомпетентных клеток. С учетом важной роли гиалуронансвязывающих белков в проявлении уникальных иммунологических свойств ГК возможно развитие новой стратегии иммуномодуляции и иммунокоррекции хронических дерматозов, профилактики и лечения фото- и хроностарения кожи, которая будет основана на применении препаратов ГК различной молекулярной массы и комбинированных препаратов на ее основе.
Иммунотропные эффекты гиалуроновой кислоты в коже
 В дерме ГК образует каркас, к которому присоединяются другие гликозаминогликаны (прежде всего, хондроитинсульфат) и белки, называемые за их способность специфически связываться с ГК гиаладгеринами. При этом происходит образование полимерной сети, которая заполняет большую часть экстрацеллюлярного пространства, обеспечивая механическую поддержку тканей, быструю диффузию водорастворимых молекул и миграцию клеток. В эпидермисе ГК локализуется в перицеллюлярном пространстве, создавая ареол, окружающий клетку и защищающий ее от действия токсичных веществ [42]. В дерме ГК образует каркас, к которому присоединяются другие гликозаминогликаны (прежде всего, хондроитинсульфат) и белки, называемые за их способность специфически связываться с ГК гиаладгеринами. При этом происходит образование полимерной сети, которая заполняет большую часть экстрацеллюлярного пространства, обеспечивая механическую поддержку тканей, быструю диффузию водорастворимых молекул и миграцию клеток. В эпидермисе ГК локализуется в перицеллюлярном пространстве, создавая ареол, окружающий клетку и защищающий ее от действия токсичных веществ [42].
В интактной, здоровой коже высокомолекулярные и низкомолекулярные фракции ГК находятся в динамическом равновесии, которое сдвинуто в сторону высокомолекулярных фракций (молекулярная масса более 1 000 000 Да), обладающих хорошими влагоудерживающими и противовоспалительными свойствами.
При избыточном ультрафиолетовом облучении, бактериальной инвазии, травматизации, хронических заболеваниях, воздействии аллергенов и других неблагоприятных факторов в коже развивается острое или хроническое воспаление, в результате которого в составе ГК начинают преобладать низкомолекулярные фракции, обладающие провоспалительными и иммуностимулирующими свойствами.
ГК является уникальной молекулой, которая принимает участие во всех стадиях развития воспаления в коже - от альтерации до пролиферации. Во время альтерации под действием активных форм кислорода, продуцируемых нейтрофилами, и тканевых и бактериальных гиалуронидаз наблюдается деградация высокомолекулярных фракций ГК и других компонентов внеклеточного матрикса [38]. Образуется большое количество олигосахаров, которые взаимодействуют с рецепторами CD44, RHAMM, TLR2 и TLR4 на поверхности макрофагов, лимфоцитов, фибробластов, что обеспечивает их миграцию в зону повреждения. Кроме того, олигосахара связываются с рецепторами клеточной адгезии эндотелия сосудов, что способствует выходу в зону воспаления циркулирующих в крови лейкоцитов и лимфоцитов. Взаимодействие низкомолекулярных фрагментов ГК с рецепторами CD44, RHAMM, TLR2 и TLR4 приводит к активации внутриклеточных реакций и к синтезу иммунокомпетентными клетками, фибробластами и кератиноцитами провоспалительных цитокинов, которые выступают в роли медиаторов иммунного ответа, регулируют функции иммунокомпетентных клеток, обеспечивают их взаимодействие в воспалительных реакциях. Кроме того, провоспалительные цитокины еще больше усиливают экспрессию рецепторов CD44, RHAMM, TLR2 и TLR4 на мембране иммунокомпетентных клеток и фибробластов, с которыми соединяются фрагменты ГК. В результате происходит дифференцировка и пролиферация данных клеток, повышается синтез компонентов внеклеточного матрикса и ГК, происходит рост новых сосудов. Вокруг очага повреждения формируется биологический барьер, который ограничивает зону повреждения и создает благоприятные условия для пролиферации и репарации [12].
Таким образом, ГК можно назвать важным регулятором функций иммунных клеток в коже. Фрагменты с низкой молекулярной массой выступают в роли сигнальных молекул, сообщающих о повреждении тканей и мобилизирующих иммунные клетки, в то время как высокомолекулярные формы ГК подавляют иммунные функции клеток и предотвращают чрезмерное обострение воспаления.
Иммунологические эффекты внутридермальных инъекций различных форм ГК при лечении фото- и хроностарения
Нарушения нормальных иммунных реакций в коже приводят к развитию многих дерматологических заболеваний и подавляющего большинства эстетических проблем, в том числе к преждевременному старению кожи. В стареющей коже наблюдаются мононуклеарная инфильтрация, снижение числа клеток Лангерганса и изменение продукции иммунокомпетентными клетками цитокинов, влияющих на пролиферацию и дифференцировку клеток кожи [1].
Клинические исследования и опыт практикующих специалистов доказывают высокую эффективность внутридермальных инъекций нативной и модифицированной ГК при фото- и хроностарении кожи. После курса лечения повышаются влажность и эластичность кожи, происходят нормализация ее тургора, выравнивание рельефа, уменьшение глубины морщин, улучшение цвета лица [7, 11]. Стимулируется синтез собственных гликозаминогликанов, в том числе ГК, улучшается микроциркуляция в коже. Ингибируется синтез матриксных металлопротеиназ, снижается выраженность реакций свободнорадикального окисления, подавляются процессы патологической деградации компонентов внеклеточного матрикса, связываются токсины и обеспечивается адекватный дренаж [4, 42].
В настоящее время существует несколько методов коррекции и лечения фото- и хроностарения кожи с использованием препаратов на основе ГК. Первый метод носит название «биоревитализация». Он заключается во внутридермальных инъекциях нативной или модифицированной ГК с молекулярной массой 1 000 000-1 300 000 Да в концентрации 8-25 мг/мл. Второй метод - это мезотерапевтическое введение ГК в составе различных коктейлей. Концентрация ГК при этом составляет в среднем 5 мг/мл и менее, а разброс молекулярной массы может быть достаточно широким - от низкомолекулярных до высокомолекулярных фракций.
 При введении ГК в составе мезотерапевтических коктейлей в коже под действием тканевых гиалуронидаз и свободных радикалов сразу же начинается ее достаточно быстрая биодеградация с накоплением низкомолекулярных фрагментов и олигосахаров. Они повышают экспрессию гиалуронансвязывающих белков (рецепторов) на поверхности иммунокомпетентных клеток, фибробластов и кератиноцитов, связываются с ними и запускают каскад внутриклеточных реакций, которые включают в себя синтез биологически активных веществ: цитокинов, факторов роста. Обеспечивается миграция разных типов клеток в зону инъекции, происходит активация процессов дифференцировки клеток, стимулируются пролиферация фибробластов, синтез коллагена, эластина и ГК, рост новых сосудов. Происходит ревитализация, активируется иммунная функция клеток кожи, наступает качественное обновление компонентов межклеточного матрикса. При введении ГК в составе мезотерапевтических коктейлей в коже под действием тканевых гиалуронидаз и свободных радикалов сразу же начинается ее достаточно быстрая биодеградация с накоплением низкомолекулярных фрагментов и олигосахаров. Они повышают экспрессию гиалуронансвязывающих белков (рецепторов) на поверхности иммунокомпетентных клеток, фибробластов и кератиноцитов, связываются с ними и запускают каскад внутриклеточных реакций, которые включают в себя синтез биологически активных веществ: цитокинов, факторов роста. Обеспечивается миграция разных типов клеток в зону инъекции, происходит активация процессов дифференцировки клеток, стимулируются пролиферация фибробластов, синтез коллагена, эластина и ГК, рост новых сосудов. Происходит ревитализация, активируется иммунная функция клеток кожи, наступает качественное обновление компонентов межклеточного матрикса.
При внутридермальном введении высокомолекулярной нативной или модифицированной ГК биодеградация ее происходит довольно медленно (скорость зависит от степени химической модификации). Высокомолекулярная ГК хорошо удерживает в тканях воду, обеспечивая возрастной дегидратированной коже оптимальные условия для функционирования клеток, протекания обменных процессов, межклеточных взаимодействий.
В коже высокомолекулярная ГК сначала оказывает противовоспалительный и иммуносупрессивный эффекты; их длительность зависит от степени химической модификации молекулы ГК. Затем постепенно, от периферии к центру, под действием тканевых гиалуронидаз и свободных радикалов начинается постепенная биодеградация введенной ГК до низкомолекулярных фрагментов, обладающих иммуностимулирующими свойствами и оказывающих влияние на клеточную пролиферацию, дифференцировку, миграцию и ангиогенез.
Таким образом, при введении в кожу высокомолекулярной ГК на первый план выходят ее увлажняющие и противовоспалительные свойства, а затем - ревитализирующие. Введение же ГК в составе мезотерапевтических коктейлей обеспечивает быстрые, но не длительные ревитализирующий и увлажняющий эффекты.
В заключение хочется отметить, что при использовании препаратов ГК в различных областях медицины мы получаем многообразие лечебных эффектов в отсутствие осложнений. Наружное применение ГК для лечения кожных ран клинически и патогенетически обосновано. Вместе с тем, влияние ГК на регенераторные процессы в соединительной и эпителиальной тканях и ее иммунотропные эффекты при внутридермальном введении требуют дальнейшего изучения. Требуют изучения и механизмы иммунологической регуляции регенерации кожи, а также влияние на эти процессы внутридермального введения химически модифицированных биодеградируемых производных ГК.
Перспективным выглядит исследование иммунотропных и противовоспалительных эффектов внутридермальных инъекций ГК в комплексном лечении и профилактике рецидивов хронических дерматозов, таких как угревая болезнь и розацеа.
Изучение механизмов иммунологической регуляции регенерации кожи при внутридермальном введении нативной и модифицированной ГК и разработка на этой основе новых технологий восстановления функций кожи в случае нарушения ее регенераторных способностей при воспалении и заживлении ран является актуальной медико-биологической задачей.
Литература
- Базарный В. В. Иммунная система кожи. Мезотерапия 2011; № 2:28-36.
- Базарный В. В., Валамина И. Е., Тихонина Е. А. и др. Иммуномодуляция рибомунилом репаративных процессов в коже крыс. Бюллетень экспериментальной биологии и медицины 2007; 143:660-662.
- Вавилов A. M., Самсонов В. А., Димант Л. Е., Завалишина Л. Э. Иммуноморфологические исследования Т-лимфоцитов в коже больных псориазом. Вестник дерматологии 2000; № 4:4-7.
- Губанова Е., Чайковская Е. Интрадермальные инъекции гиалуроновой кислоты: возможные механизмы формирования клинических эффектов. Инъекционные методы в косметологии 2009; октябрь:20-30.
- Зимина И. В., Лопухин Ю. М., Арион В. Я. Кожа как иммунный орган: клеточные элементы и цитокины. Иммунология 1994; № 1:8-13.
- Катунина О. Р. Иммунная система кожи и ее роль в патогенезе псориаза. Вестник дерматологии 2005; № 1:19-22.
- Ляшенко Ю. Сочетание биоревитализации с аппаратными методами и химическими пилингами. Инъекционные методы в косметологии 2010; № 1:54-59.
- Матчин Е. Н., Потапов В. Л., Строителев В. В., Федорищев И. А. Гиалуроновая кислота в лечении ран и ожогов. Комбустиология 2002; 11:38-39.
- Машкиллейсон А. Л.,Зайцева С. Ю. Роаккутан в лечении тяжелых форм угревой сыпи. Вестник дерматологии и венерологии 1989; № 9:61-63.
- Орлова Н. А. Выбор лечебной тактики у больных различными формами акне. Автореф. дис. ... канд. мед. наук. - Москва, 2006.
- Парсагашвили Е. Биоревитализация // Новая косметология. Том II . - М.: Косметика и медицина, 2007; стр. 268-277.
- Петрович А. Биоревитализация в терапии угревой болезни. Инъекционные методы в косметологии 2009; октябрь:42-47.
- Сергеев А. Ю., Караулов А. В., Сергеев Ю. В. Иммунодерматология: иммунологические основы патогенеза главных воспалительных дерматозов человека. Иммунология, аллергология, инфектология 2003; № 3:10-23.
- Сергеева И. В., Ю.М. Криницина. Акне: патогенез и современные методы лечения. Лечащий врач 2005; № 6:15-18.
- Скрипкин Ю. К., Лезвинская Е. М. Кожа - орган иммунной системы. Вестник дерматологии и венерологии 1989; № 10:14-20.
- Ярилин А. А. Кожа как часть иммунной системы. Materia medica 1994; 2:7-36.
- Ярилин А. А., Пинчук В. Г., Гриневич Ю. А. Структура тимуса и дифференцировка Т-лимфоцитов. - Киев: Наукова думка, 1991.
- Akira S., Taga Т ., Kishimoto T. InterIeukin-6 in biology and medicine. Adv Immunol 1993; 54:1-78.
- Aruffo A., Stamenkovic I., Melnick M. et al. CD44 is the principal cell surface receptor for hyaluronate. Cell 1990; 61:1303-1313.
- Baker B. S. Recent advances in psoriasis: The role of the immune system. - London: Medicine at St Marys, 2000.
- Banerji S., Ni J., Wang S. X. et al. LYVE-1, a new homologue of the CD44 glycoprotein, is a lymph-specific receptor for hyaluronan. J Cell Biol 1999; 144:789-801.
- Bland J. H., Cooper S. M. Osteoarthritis: a review of the cell biology involved and evidence for reversibility. Management rationally related to known genesis and pathophysiology. Semin Arthritis Rheum 1984; 14:106-133.
- Blundell C. D., Mahoney D. J., Cordell M. R. et al. Determining the molecular basis for the pH-dependent interaction between the link module of human TSG-6 and hyaluronan. J Biol Chem 2007; 282:12976-12988.
- Bollyky P. L., Falk B. A., Wu R. P. et al. Intact extracellular matrix and the maintenance of immune tolerance: high molecular weight hyaluronan promotes persistence of induced CD4+CD25+ regulatory T cells. J Leukoc Biol 2009; 86:567-572.
- Bollyky P. L., Wu R. P., Falk B. A. et al. ECM components guide IL-10 producing regulatory T-cell (TR1) induction from effector memory T-cell precursors. Proc Natl Acad Sci USA 2011; 108:7938-7943.
- Bourguignon L. Y. W., Zhu D., Zhu H. CD44 isoform-cytoskeleton interaction in oncogenic signaling and tumor progression. Front Biosci 1998; 3:d637-d649.
- Day A. J., de la Motte C. A. Hyaluronan cross-linking: a protective mechanism in inflammation? Trends Immunol 2005; 26:637-643.
- Della Valle F., Romeo A. Hyaluronic acid fractions having pharmaceutical activity, and pharmaceutical compositions containing the same. Patent US № 5925626, 1999.
- Delmage J. M., Powars D. R., Jaynes P. K., Allerton S. E. The selective suppression of immunogenicity by hyaluronic acid. Ann Clin Lab Sci 1986; 16:303-310.
- Egren U. M, Tammi R. H, Tammi M. I. Reactive oxygen species contribute to epidermal hyaluronan catabolism in human skin organ culture. Free Radic Biol Med 1997; 23:996-1001.
- Forrester J. V., Balazs E. A. Inhibition of phagocytosis by high molecular weight hyaluronate. Immunology 1980; 40:435-446.
- Goueffic Y., Guilluy C., Guerin P. et al. Hyaluronan induces vascular smooth muscle cell migration through RHAMM-mediated PI3K-dependent Rac activation. Cardiovasc Res 2006; 72:339-348.
- Haynes B. F., Hale L. P., Patton K. L. et al. Measurement of an adhesion molecule as an indicator of inflammatory disease activity. Up-regulation of the receptor for hyaluronate (CD44) in rheumatoid arthritis. Arthritis Rheum 1991; 34:1434-1443.
- Jackson D. G. Biology of the lymphatic marker LYVE-1 and applications in research into lymphatic trafficking and lymphangiogenesis. APMIS 2004; 112:526-538.
- Jackson D. G., Prevo R., Clasper S., Banerji S. LYVE-1, the lymphatic system and tumor lymphangiogenesis. Trends Immunol 2001; 22:317-321.
- Lee T. H., Wisniewski H. G., Vilcek J. A novel secretory tumor necrosis factor-inducible protein (TSG-6) is a member of the family of hyaluronate binding proteins, closely related to the adhesion receptor CD44. J Cell Biol 1992; 116:545-557).
- Lesley J., Hyman R., Kincade P. W. CD44 and its interaction with extracellular matrix. Adv Immunol 1993; 54:271-335.
- McNeil J. D., Wiebkin O. W., Betts W. H., Cleland L. G. Depolimerisation products of hyaluronic acid after exposure to oxygen-derived free radicals. Ann Rheum Dis 1985; 44:780-789.
- Meyer K. Highly viscous sodium hyaluronate. J Biol Chem 1948; 176:993-997.
- Mikecz K., Brennan F. R., Kim J. H., Glant T. T. Anti-CD44 treatment abrogates tissue oedema and leukocyte infiltration in murine arthritis. Nat Med 1995; 1:558-563.
- Moffat F. L. Jr., Han T., Li Z. M. et al. Involvement of CD44 and the cytoskeletal linker protein ankyrin in human neutrophil bacterial phagocytosis. J Cell Physiol 1996; 168:638-647.
- Presti D., Scott J. E. Hyaluronan-mediated protective effect against cell damage caused by enzymatically produced hydroxyl radicals is dependent on hyaluronan molecular mass. Cell Biochem Funct 1994; 12:281-288.
- Scheibner K. A., Lutz M. A., Boodoo S. et al. Hyaluronan fragments act as an endogenous danger signal by engaging TLR2. J Immunol 2006; 177:1272-1281.
- Shen L., Zhuo L., Okumura A. et al. The SHAP-hyaluronan complex in serum from patients with chronic liver diseases caused by hepatitis virus infection. Hepatol Res 2006; 34:178-186.
- Termeer C., Benedix F., Sleeman J. et al. Oligosaccharides of hyaluronan activate dendritic cells via toll-like receptor 4. J Exp Med 2002; 195:99-111.
- Termeer C. C., Hennies J., Voith U. et al. Oligosaccharides of hyaluronan are potent activators of dendritic cells. J Immunol 2000; 165:1863-1870.
- Tesar B. M., Jiang D., Liang J. et al. The role of hyaluronan degradation products as innate alloimmune agonists. Am J Transplant 2006; 6:2622-2635.
- Toole B. P. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer 2004; 4:528-539.
- Walsh N. M., Prokopetz R., Tron V. A. et al. Histopathology in erythroderma: review of a series of cases by multiple observers. J Cutan Pathol 1994; 21:419-423.
- Wisniewski H. G., Hua J. C., Poppers D. M. et al. TNF/IL-1-inducible protein TSG-6 potentiates plasmin inhibition by inter-alpha-inhibitor and exerts a strong anti-inflammatory effect in vivo. J Immunol 1996; 156:1609-1615.
- Wrobel T., Dziegiel P., Mazur G. et al. LYVE-1 expression on high endothelial venules (HEVs) of lymph nodes. Lymphology 2005; 38:107-110.
- Zaman A., Cui Z., Foley J. P. et al. Expression and role of the hyaluronan receptor RHAMM in inflammation after bleomycin injury. Am J Respir Cell Mol Biol 2005; 33:447-454.
- Губанова Е., Чайковская Е. Интрадермальные инъекции гиалуроновой кислоты: возможные механизмы формирования клинических эффектов. Инъекционные методы в косметологии 2009; октябрь:20-30.
|

