|
|
Световой режим, риск возникновения рака. Противоопухолевое действие мелатонина
Анисимов В.Н.
Эпидемиологические исследования. Сменно-вахтовый труд и риск
развития рака
Согласно данным Международного агентства по изучению рака, в 2000 г. рак молочной железы составил большую часть заболеваний в развитых странах. Наиболее распространенным злокачественным новообразованием среди женщин - раком молочной железы (РМЖ), заболевает ежегодно 999000 женщин (22% от всех злокачественных новообразований у женщин), в результате чего умирает 375000 человек. Более половины всех новых случаев зарегистрировано в экономически развитых странах: около 335000 в Европе и 195000 в Северной Америке. РМЖ еще не является самым распространенным среди женщин в развивающихся странах, однако и в них наблюдается неуклонный рост заболеваемости. Возрастающий риск развития РМЖ обусловлен высоким социально-экономическим статусом (годовой доход, образование, жилье и т.д.), поскольку он связан с такими показателями здоровья, как начало менструальной функции и менопаузы, ожирение, высокий рост, потребление алкоголя, поздний возраст первых родов, малое количество родов, гормонозаместительная терапия, особенности питания и т.д. Следует отметить еще два фактора, характерных для развитых стран, которые могут иметь важное значение - увеличивающееся воздействие освещением ночью и низкочастотные электромагнитные поля (50-60 Гц).
В настоящее время в некоторых отраслях промышленности число работающих посменно людей довольно значительно. Общее количество рабочих, имеющих ночную работу или работу по сменам, достигает 20% в США и 15-20% от общего количества работающих в большинстве стран Европейского Экономического Сообщества. Очевидные проблемы со здоровьем среди сменных рабочих включают нарушения сна, желудочно-кишечные заболевания, увеличение случаев сердечно-сосудистых заболеваний, нарушение метаболизма и толерантности к липидам и, возможно, увеличение случаев развития диабета. Показано, что ожирение, высокий уровень триглицеридов и холестерина, низкая концентрация липопротеинов высокой плотности (ЛПВП) обнаруживаются в этой группе чаще, чем у рабочих дневных смен. С другой стороны, имеются доказательства, показывающие, что метаболический синдром, который представлен ожирением, высоким уровнем триглицеридов и холестерина, липопротеинов низкой плотности, гипертонией, сниженной фибринолитической активностью крови, сниженной толерантностью к глюкозе, является не только фактором риска сердечно-сосудистых заболеваний, но и фактором риска возникновения злокачественных опухолей.
Сообщают о гораздо большем количестве смертей от злокачественных новообразований у сменных рабочих, которые работали на производстве не менее 10 лет, по сравнению с рабочими, занятыми только в дневные смены. В Дании в большом контролируемом рандомизированном исследовании (около 7000 обследуемых в каждой группе) было показано, что занятие вечерней работой достоверно увеличивает риск развития рака молочной железы (РМЖ) у женщин в возрасте от 30 до 54 лет. Среди работающих ночью наиболее достоверные результаты были обнаружены у официантов ресторанов, работающих в ночные смены (300 случаев). Подобные наблюдения были сделаны при обследовании стюардесс в большом когортном исследовании риска РМЖ в Финляндии. У калифорнийских стюардесс РМЖ встречался на 30% чаще и злокачественная меланома обнаруживалась в 2 раза чаще, по сравнению с другим населением Калифорнии. С другой стороны, в недавнем контролируемом исследовании не было получено никаких убедительных доказательств, что риск РМЖ среди финских стюардесс выше, чем у других женщин.
Интересные результаты были получены в проведенном С. Дэвисом в 2001 г. в США эпидемиологическом рандомизированном исследовании. У 813 больных раком молочной железы женщин изучали особенности образа жизни за последние 10 лет по сравнению со здоровыми женщинами. При этом, учитывали экспозицию к свету в ночное время, основываясь на следующих показателях: ночная бессонница, уровень освещения в спальне ночью и работа в ночные смены (не менее 3-х ночей в месяц). Оказалось, что риск рака возрастает с учащением ночной бессонницы, увеличением уровня ночного освещения и при работе в ночную смену. В последнем случае риск также возрастал с увеличением стажа работы (табл. 1).
По данным Е. Шернхаммер с соавт. (2001), основанных на исследовании состояния здоровья медицинских сестер, включавшем в себя вопросы о стаже, сменной работе, дневных, ночных и вечерних сменах, среди медсестер, имеющих стаж более 30 лет и сменную работу, относительный риск РМЖ составлял 1,36 по сравнению с медицинскими сестрами, которые не работали посменно. У медсестер, длительно работающих в ночные смены, был найден сниженный уровеньмелатонина и повышенный уровень эстрогенов в крови. Проведенный мета-анализ, основанный на 13 исследованиях, включающих семь исследований работников авиалиний и шесть исследований представителей других профессий, работающих в ночные смены, показал, что общая оценка риска равнялась 1,48. Существенный риск развития РМЖ имели летный состав авиалиний и женщины, работающие в ночные смены.
В исследовании, объектом которого были данные о здоровье почти 45 тысяч медицинских сестер в Норвегии, было установлено, что показатель дополнительного риска РМЖ у работавших по ночам в течение 30 и более лет составил 2,21. Увеличенный риск РМЖ и рака толстой кишки был обнаружен у длительно работавших по ночам жителей Сиэттла (США).
Были получены данные об увеличенном риске рака толстой кишки и рака прямой кишки у женщин, работающих на радио и телеграфе. В 2003 г. Е. Шернхаммер и ее коллеги, рассмотрев Гарвардские данные по изучению состояния здоровья 79 тысяч медсестер, обнаружили, что медсестры, работающие в ночные смены, имеют более высокий риск РМЖ. Авторы также нашли, что рак толстой и прямой кишки встречаются чаще у рабочих, имеющих не менее 3 ночных смен в месяц в течение 15 и более лет. В 2007 г. эта же группа сообщила о существенно увеличенном риске рака эндометрия среди женщин, более 20 лет имевших сменный характер работы. Повышенный риск злокачественных лимфом был обнаружен среди исландских стюардесс. Сообщают об увеличении риска возникновения рака простаты у скандинавских пилотов авиалиний в зависимости от количества продолжительных рейсов. Механизмы, лежащие в основе увеличенного риска рака среди ночных рабочих и летных экипажей, возможно, схожи. Вероятно, нарушение циркадианных ритмов и вынужденное воздействие света в ночное время приводят к уменьшению выработки мелатонина, являющегося известным биологическим блокатором развития злокачественных новообразований.
Влияние ночного освещения
на канцерогенез
Еще в 1964 г. немецкий исследователь В. Йохле сообщил, что количество опухолей молочной железы и обусловленных ими смертей у мышей, содержавшихся в помещении с круглосуточным освещением, значительно больше, чем животных, находившихся при обычном световом режиме. Аналогичная закономерность прослеживалась и в отношении других опухолей. В 1966 году сотрудник Онкологического научного центра в Москве И.О. Смирнова обнаружила развитие гиперпластических процессов в молочной железе и мастопатий у 78-88% самок крыс через 7 месяцев после начала воздействия постоянного освещения. По данным И.А. Виноградовой из Петрозаводского государственного университета, доложенным в 2005 году на научной конференции «Световой режим, старение и рак» в г. Кондопоге, при содержании в условиях постоянного освещения до 18-месячного возраста доживает чуть больше половины самок крыс, тогда как почти 90% крыс были живы к этому сроку в комнате, в которой поддерживался стандартный режим освещения. Спонтанные опухоли были обнаружены у 30% крыс, содержавшихся при постоянном освещении, против 16% - при стандартном режиме освещения.
В опытах, проведенных в нашей лаборатории Д.А. Батуриным, воздействие постоянного освещения у самок мышей, несущих ген рака молочной железы HER-2/neu, сопровождалось увеличением множественности аденокарцином молочной железы по сравнению с группой стандартного освещения. Следует отметить, что эффект постоянного освещения был пропорционален интенсивности освещения. Воздействие постоянного освещения значительно ускоряло возрастные нарушения репродуктивной функции и существенно усиливало спонтанный канцерогенез у мышей линии СВА. Немецкий исследователь К. Бартш обнаружил, что постоянное освещение, начатое в возрасте 30 дней, приводило к ускорению развития спонтанных аденокарцином эндометрия у крыс линии BDII/Han.
Влияние нарушений циркадных
ритмов на канцерогенез
Мыши с полной мутацией гена Per2, приводящей к нарушению циркадианного ритма, имели повышенную восприимчивость к развитию лимфом после воздействия ?-радиации. Было также показано, что эти мыши более склонны к спонтанному развитию опухолей по сравнению с контрольными животными.
Остеосаркома Глазго или аденокарцинома поджелудочной железы P03 были пересажены интактным (контрольным) мышам или мышам с двусторонним электрическим разрушением СХЯ гипоталамуса. Рост опухолей был быстрее у животных с поврежденными СХЯ, чем у ложно оперированных. Разрушение СХЯ являлось главной причиной нарушения циркадианной ритмики кортикостерона и ритма деления лимфоцитов у этих мышей.
В клинических исследованиях отмечено, что сохраненный 24-часовой ритм активности связан с более длительным выживанием пациентов с метастатическим раком толстой кишки. Недавно были выявлены нарушения экспрессии трех часовых генов (PER1, PER2, PER3) в большинстве (<95%) клеток рака молочной железы у женщин. Это может привести к нарушению контроля над нормальным циркадианым ритмом и, таким образом, увеличить выживание раковых клеток и усилить неопластический процесс. В настоящее время пока не ясно, уникален ли ген Per2 в качестве «супрессора опухоли» или имеются другие часовые гены, выполняющие подобную противоопухолевую функцию в естественных условиях. Механизм подавления роста опухоли также пока не ясен, но имеется важное наблюдение - раковые ткани определенно связаны со специальными часовыми генами. В течение 2006 года было опубликовано еще 6 работ, свидетельствующих о нарушениях в функции часовых генов у больных раком ряда других локализаций.
Данные, полученные на крысах и людях, показывают, что опухоли и имеющие опухоль особи могут иметь значительно измененные циркадианные ритмы. Мы наблюдали существенное нарушение циркадианного ритма мелатонина в сыворотке крови, активности пинеалоцитов и содержания биогенных аминов в СХЯ гипоталамуса и преоптической области у крыс, имеющих рак толстой кишки, вызванный 1,2-диметилгидразином.
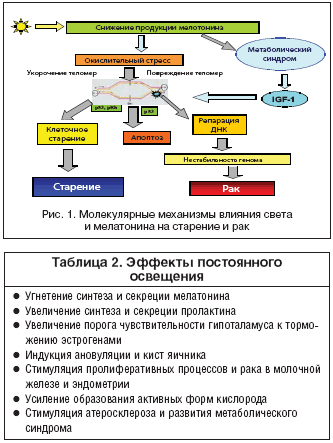
Экологические и генетические факторы, которые повреждают системный и/или местный циркадианный ритм, могут ставить под угрозу временное регулирование деления клеток и таким образом усиливать рост опухоли (табл. 2).
Темнота и рак
Если свет, подавляющий продукцию мелатонина эпифизом, стимулирует преждевременное старение и развитие рака, то естественен вопрос - а как действуетна эти процессы темнота? Доктор А.К. Кураласов из Алма-Аты в 70-80 годах прошлого века изучал влияние темноты на рост и развитие опухолей молочных желез у крыс. Животные содержались в темном помещении (0-0,5 люкс/см2) или при стандартном световом режиме (12 ч свет/12 ч темнота). Оказалось, что рост перевиваемого рака молочной железы в темноте существенно замедлялся. Введение канцерогена ДМБА крысам, которых содержали в темноте, индуцировало гораздо меньше опухолей молочной железы, чем у содержавшихся при стандартном освещении. Продолжительность жизни крыс с опухолями молочной железы в группе, содержавшейся в темноте, была в 2 раза большей, чем у животных в контрольной группе, находившейся в условиях стандартного светового режима. А.К. Кураласов установил также, что содержание животных в темноте усиливало противоопухолевый эффект таких препаратов, как синестрол, тамоксифен, андрогены, тио-TEФA, циклофосфамид, ЦМФ, тиo-TEФA +синестрол.
Впечатляющие результаты экспериментальных исследований позволили автору использовать этот подход для терапии больных РМЖ. Под наблюдением находилось 138 пациентов (T2-4 N2-3 M0). Некоторые из них (54 случая) получали полихимиотерапию (модифицированная схема Купера + гормонотерапия). Радиотерапия проводилась 46 больным, радиотерапия с химиотерапией - 38 больным. У больных с РМЖ в пременопаузе наблюдался пониженный уровень 17b-эстрадиола (в 7 раз) и ФСГ в сыворотке крови, тогда как уровень тестостерона и прогестерона был повышен, по сравнению с параметрами этих гормонов у этих же больных до воздействия режимом постоянной темноты. У женщин в постменопаузе эти изменения были менее выражены, чем у женщин в пременопаузе. Дексаметазоновый тест был отрицательным у 62,5% больных раком молочной железы, находившихся при стандартном световом режиме, и только у 9,5% больных, находившихся в темноте. Полная или частичная (>50%) регрессия карциномы молочной железы наблюдалась у 32,4 % больных контрольной группы и у 78,6% больных «темновой» группы. Индекс операбильности в этих группах составил 36 % и 88 %, соответственно.
Таким образом, опыты с грызунами и наблюдения клиницистов убедительно свидетельствуют об ингибирующем действии световой депривации на канцерогенез молочной железы. Эпидемиологические данные также подтверждают такой вывод. Американский эпидемиолог Р. Хан в 1991 году сообщил о результатах анализа свыше 100000 выписных эпикризов, опубликованных в Национальном госпитальном регистре. Риск развития рака молочной железы оказался в 2 раза меньшим у первично слепых женщин по сравнению со зрячими. В ряде исследований, выполненных в последние годы учеными Швеции и Финляндии, было обнаружено существенное снижение риска всех видов рака среди слепых, и этот уменьшенный риск является специфичным для рака молочной железы у женщин.
Влияние мелатонина на развитие
опухолей у животных и человека
В опытах на различных моделях индуцированного химического канцерогенеза было обнаружено, что применение мелатонина оказывает угнетающее влияние навозникновение и развитие опухолей молочной железы, шейки матки и влагалища, кожи, подкожной клетчатки, легких, эндометрия, печени, толстой кишки у животных, что свидетельствует о значительной широте спектра антиканцерогенного эффекта мелатонина. Противоопухолевому действию мелатонина in vitro и in vivo также посвящено большое количество работ. Данные исследований на животных хорошо согласуются с результатами клинических наблюдений. Так, в работе канадских исследователей Э. Милса и соавт. (2005) представлены результаты мета-анализа 10 рандомизированных контролируемых исследований эффективности применения мелатонина для лечения онкологических больных с солидными формами опухолей. В общей сложности лечение получили 643 пациента.
Применение мелатонина снизило относительный риск смерти в течение 1 года до 0,66, причем, не было зарегистрировано серьезных побочных эффектов препарата.
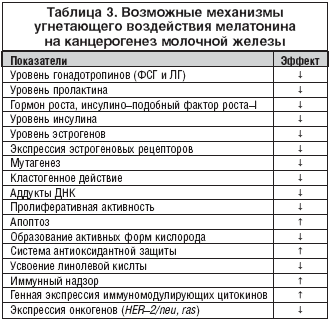
Возможные механизмы ингибирующего воздействия мелатонина на канцерогенез молочной железы интенсивно обсуждаются в последнее время (табл. 3). Установлено, что мелатонин оказывает эффект как на системном, так и на тканевом, клеточном и субклеточном уровнях. При этом действие мелатонина препятствует процессам, ведущим к старению и раку. В частности, на системном уровне мелатонин снижает продукцию гормонов, способствующих этим процессам и стимулирует систему иммунного надзора. Одновременно подавляется продукция свободных радикалов кислорода и стимулируется система антиоксидантной защиты. Мелатонин тормозит пролиферативную активность клеток и повышает уровень апоптоза, препятствуя возникновению и развитию опухолевого процесса. На генетическом уровне он ингибирует эффект мутагенов и кластогенов, а также подавляет экспрессию онкогенов (рис. 1).
Представленные данные свидетельствуют о важной роль шишковидной железы в развитии рака. Угнетение функции эпифиза при использовании постоянного режима освещения стимулирует канцерогенез. Эпидемиологические наблюдения относительно увеличения риска РМЖ и
РТК у рабочих ночных смен соответствуют результатам экспериментов на грызунах. Применение эпифизарного гормона мелатонина угнетает канцерогенез у животных, находящихся в условиях как обычного режима освещения, так и при постоянной освещении.
Таким образом, применение мелатонина с целью профилактики рака может оказаться весьма эффективным, особенно в северных регионах, где летом имеют место «белые ночи», а в течение долгой полярной ночи всюду горит электрический свет.
Суммируя все вышесказанное, можно заключить, что спектр эффектов мелатонина очень широк. В отличие от многих гормонов его действие на клеточные структуры зависит не только от его концентрации в крови и межклеточной среде, но и от исходного состояния клетки. Это позволяет считать мелатонин универсальным эндогенным адаптогеном, поддерживающим баланс организма на определенном уровне и позволяющим адаптировать все происходящие процессы к непрерывно меняющимся условиям окружающей среды и локальным воздействиям на организм.

|

