
|
|
 |
|||||||||
| |||||||||
|
Оккупация на клеточном уровне
В развитых странах уже несколько десятилетий онкологические заболевания устойчиво занимают второе место в перечне болезней, приводящих к смертельному исходу. Но несмотря на такое распространение, точные первопричины того или иного онкологического заболевания не знают ни физиологи, ни анатомы, ни онкологи. И само название «рак» - не более чем загадка: в облике больных, в механизмах действия болезни нет ничего такого, что имело бы сходство с безобидным речным обитателем. Впрочем, более точное название - злокачественная опухоль - тоже не очень проясняет смысл. Вопреки законам русского языка в этом названии главное - не существительное, а прилагательное. Ведь опухолью выглядят и шишка на лбу, и фурункул, и гематома в месте удара. А при некоторых формах злокачественных новообразований, например при лейкозах, опухолей вообще не бывает.Что же такое рак и можно ли его победить? Причин, влияющих на развитие этой болезни, множество: радиация, вещества-канцерогены, вирусы, наследственность. С возрастом риск заболевания увеличивается, однако злокачественные новообразования возникают и у детей, а изредка - даже у младенцев в утробе. Есть разновидности опухолей, характерные для определенных профессий, местности или даже национальности. Долгое время их изучение оставалось вне контекста медицинской науки: ни один из аспектов многочисленных исследований не мог обнаружить истинных причин поражения органов, тканей и крови. И только в последние десятилетия усилия специалистов разных областей медицины выявили некоторые механизмы развития рака. Как это часто бывает в биологии, оказалось, что вопрос надо было вывернуть наизнанку: чтобы выяснить, почему клетки иногда становятся злокачественными, надо сначала узнать, почему обычно они этого не делают. Клетки-самураиУ одноклеточных организмов процесс размножения ограничен условиями внешней среды: наличием в ней пищи и кислорода, низкой концентрацией вредных веществ (в том числе собственных отходов), температурой, соленостью и т .д. Переход к многоклеточности позволил уйти от этой зависимости: что бы там ни было снаружи, внутренняя среда высокоорганизованного существа всегда сохраняется. Кислород и питательные вещества постоянно доставляются каждой клетке, ядовитые продукты обмена столь же постоянно выводятся наружу. И даже размножаться всем клеткам не надо. За этот процесс несут ответственность специальные клетки и ткани. Хотя и у них способность к делению ограничена: например, у женщин все будущие яйцеклетки закладываются еще до рождения и в дальнейшем уже не приумножаются. Зрелые клетки нашего организма (нервные, мышечные, кровяные и прочие) обычно вообще лишены этой возможности. Эту миссию выполняют стволовые клетки, которые заменяют выбывшие из строя клетки ткани. Но и их деление строго контролируется - как, собственно, и вся жизнь любой клетки многоклеточного существа. Каждой из них организм точно указывает, когда и с какой интенсивностью ей делиться и делиться ли вообще, где находиться и что делать, жить или умереть. Самоубийство (апоптоз) для наших клеток столь же обычный финал, как харакири для самураев. Кстати, два этих феномена сходны технически: в процессе апоптоза клетка рубит свои внутренние структуры на мелкие куски. Она убивает себя, когда орган, в состав которого она входила, более не нужен организму (например, хвост - головастику, превращающемуся в лягушонка), когда она случайно оказалась в чужеродной ткани, когда ее генетический аппарат сильно поврежден, когда ее поведение в организме признано неправильным или подозрительным. Известный российский биохимик Владимир Скулачев даже сформулировал «самурайский закон поведения клетки»: лучше умереть, чем ошибиться. Но для того чтобы клетка подчинялась командам и запретам, нужна система сигналов, передающих эти команды, и аппарат, способный их воспринимать. Этими сигналами служат вещества, получившие название цитокинов. По своей химической природе это обычно белки или полипептиды - более короткие, чем белки, цепочки аминокислот. Они связываются с расположенными на внешней мембране клетки белками-рецепторами, изменяют их состояние, и те запускают цепочку реакций - активируют одни молекулы и выводят из игры другие. Впрочем, в межклеточной среде почти всегда присутствует какое-то количество цитокинов, и клетка реагирует не на единичную молекулу, а на то, что их концентрация превышает некий порог. Иногда отсутствие определенного цитокина само становится сигналом. Так, например, если концентрация факторов роста (цитокинов, побуждающих клетку делиться) высока - клетка делится, низка - не делится, а если их долгое время нет совсем - совершает апоптоз. Сумма ошибокИ цитокины, и предназначенные для них рецепторы кодируются генами, которые, как мы знаем, подвержены мутациям. Известна, например, мутантная форма рецептора к факторам роста, которая ведет себя, как залипающая кнопка звонка, - все время генерирует внутриклеточные сигналы к делению, независимо от того, сидит на ней сигнальная молекула или нет. Понятно, что клетка, снабженная такими рецепторами, будет все время пытаться делиться, не слушая внешних команд. Другая мутация позволяет клетке самой производить факторы роста, на которые она же будет реагировать. Но одной подобной мутации еще недостаточно, чтобы сделать клетку раковой. Деление без команды остановят другие цитокины - ингибиторы пролиферации. Есть и иные механизмы, препятствующие злокачественному перерождению клетки. Чтобы прорваться сквозь все эти барьеры и освободиться от налагаемых организмом ограничений, нужны изменения сразу в нескольких (согласно математическим моделям - от 3 до 7) не связанных друг с другом ключевых генах. Эти гены получили название протоонкогенов (абсолютно несправедливо, поскольку их нормальная работа как раз предотвращает развитие рака. Впрочем, никого же не удивляет, что устройство, включающее свет, называется выключателем.) В разных типах опухоли работают разные протоонкогены. Всего известно около 200. В марте 2005 года специалисты Национального института генома человека США объявили о намерении составить полный каталог генов, мутации которых связаны со злокачественным перерождением. Если эти представления верны, то на первый взгляд непонятно, как вообще кто-то умудряется заболеть раком. Вероятность возникновения конкретной мутации в конкретном гене очень низка, и сочетание нескольких таких мутаций в одной клетке граничит с чудом, если не принимать во внимание, сколько клеточных делений (а значит, и актов копирования генома) происходит в нашем организме. По оценкам физиологов, клетки каждого из нас делятся около двух триллионов раз в день. Мутация - событие случайное и может произойти когда угодно. Но определенные химические вещества и физические воздействия могут сильно увеличить его вероятность: все ионизирующие излучения и большинство химических канцерогенов хорошо известны как мутагены. Ясно, почему опухоль чаще всего развивается там, где много постоянно делящихся клеток: в кроветворной ткани, в коже, во всевозможных эпителиях (пищевода, желудка, кишечника, гортани, легких, матки). В других тканях опухоли возникают гораздо реже, причем, как правило, не из специализированных клеток, а из относительно редких стволовых. А, скажем, в мозгу обычно появляются только специфические детские опухоли (развивающиеся в первые годы жизни, когда клетки мозга еще делятся), либо метастазы, отделившиеся от опухоли, возникшей в какой-то другой ткани. После первой мутации могут пройти годы и десятилетия, прежде чем пораженная ею клетка приобретет злокачественность. Собственно, этого может и не случиться вовсе, если другие нужные гены так и не будут мутировать. Однако вполне вероятно, что клетка, способная к неограниченному делению и невосприимчивая к командам извне, все-таки появится на свет. Одноклеточные самсоныЧтобы превратиться в опухоль, такой клетке нужно еще многое, и прежде всего - репликативное бессмертие. Дело в том, что клетки многоклеточного организма могут делиться только ограниченное число раз (около 50). Дальше срабатывает теломерный счетчик - небольшие, ничего не значащие последовательности нуклеотидов на концах хромосом, которые при каждом делении укорачиваются на определенную величину. Правда, в геноме закодирован специальный фермент - теломераза, способный восстанавливать теломеры до исходной длины. Но в норме он присутствует только в половых и стволовых клетках, а во всех прочих его ген заблокирован. Если его не разблокировать, клетка не сможет делиться неограниченно. Новые раковые клетки делятся непрерывно, при этом контроль точности копирования ДНК резко ослаблен. Возникающие клетки становятся все разнообразнее. И начинается классический дарвиновский отбор: преимущество получают те, кто быстрее всех размножается, успешнее всех защищается от соседей и лимфоцитов, а главное, эффективнее всего обращает в свой ресурс окружающие клетки и ткани. Иными словами, по ходу возникновения и отбора новых клонов опухолевых клеток последние становятся все более активными. Метастазирование, или склонность раковых клеток отделяться от исходной опухоли, мигрировать в другие ткани и порождать там вторичные опухоли, - еще одна характерная особенность злокачественных новообразований, сильно затрудняющая борьбу с ними. Большинство клеток в организме не селится в чужеродной ткани и не выходит за пределы своего органа. Для раковых клеток запретов нет: они могут двигаться как с током крови, так и самостоятельно, проходить через любые барьеры (скажем, из кровотока в мозг, чего не могут делать даже иммунные и стволовые клетки, имеющие доступ почти всюду) и оседать в любом месте. Не реагируя на химические команды организма, раковые клетки в то же время успешно пользуются такими командами сами. Когда диаметр молодой опухоли превышает 2-4 миллиметра, клеткам, оказавшимся внутри, перестает хватать кислорода и питательных веществ. Но злокачественные клетки выделяют специальные вещества, побуждающие ближайшие кровеносные сосуды прорастать в толщу опухоли. Зрелые опухолевые клетки могут даже подавлять своими выделениями активность лимфоцитов. Живя за счет покоренного организма, они не только не пытаются уменьшить наносимый ими ущерб и тем продлить свое существование, но словно бы, наоборот, стремятся как можно скорее его погубить. Иногда развитые опухоли даже выбрасывают в кровь мощный залп вазомоторных гормонов, способных привести к остановке сердца и мгновенной смерти организма - а вместе с ним и его убийц. Это, конечно, случай редкий и крайний, но он демонстрирует общую закономерность: подобно библейскому Самсону, злокачественная опухоль стремится полностью разрушить организм, в котором находится. Рак не знает носительства, хронических форм, самопроизвольного излечения. Предоставленный сам себе, он имеет только один исход - смерть, избежать которой можно только с помощью активного и своевременного лечения.
Итак, раковые клетки - это наши собственные клетки, приобретшие способность к хаотическому делению. Однако исправить их, вернуть к отведенным в составе организма функциям нет никакой возможности. Остается поступать с ними так же, как с инородными возбудителями болезней, то есть беспощадно уничтожать. Исторически первым способом борьбы медицины против злокачественных опухолей было их оперативное удаление. Скопление переродившихся клеток вырезали обычно с большим запасом здоровой ткани, часто весь пораженный орган (молочная железа, яичник и т. д.) удалялся целиком. Но такие операции давали лишь короткую отсрочку от смерти: к тому времени, когда больной попадал под нож хирурга, из опухоли, как правило, клетки уже мигрировали дальше. Разыскать, куда они делись, можно было только после того, как из них вырастали вторичные опухоли - метастазы. Никто, конечно, и не думал отказываться от хирургического удаления опухолей, но его необходимо было подкрепить лекарственной терапией. А для этого надо было найти что-то, что отличает раковую клетку от здоровой. Одно отличие очевидно: раковая клетка непрерывно делится. Между тем с момента возникновения такой отрасли, как радиобиология, было известно, что именно делящиеся клетки особенно чувствительны к радиации. С 50-х годов прошлого века в арсенал клинической онкологии прочно входит лучевая терапия - обработка пораженного участка тела электромагнитным излучением (жестким рентгеном либо гамма-лучами) или заряженными частицами. Но лучевая терапия - такое же локальное воздействие, как и операция. Кроме того, почти все виды излучения поглощаются в поверхностных слоях ткани. Поэтому облучение эффективно в основном для лечения новообразований в коже и других покровных тканях. Иногда это ограничение удается обойти. Например, для гормона, вырабатываемого щитовидной железой, необходим йод, и его концентрация в этом органе на порядок выше, чем в любой другой ткани. Поэтому при раке щитовидной железы больного кормят радиоактивным изотопом йода, который сам концентрируется в нужном месте и поражает там беззаконные клетки. Чуть раньше лучевой терапии для борьбы с опухолями были предложены цитостатики - яды, избирательно поражающие делящиеся клетки. В отличие от ножа и облучения они настигают свои жертвы, где бы те ни находились. В этом и состоит проблема: ведь в организме постоянно делятся не только раковые клетки. Все, наверное, знают, что «от химиотерапии вылезают волосы» - цитостатики губительны для клеток волосяных луковиц, которые должны все время делиться, чтобы обеспечить рост волоса. Но когда речь идет о жизни и смерти, можно несколько месяцев походить и без волос. Помимо последних страдает и кожа, верхний слой которой непрерывно отмирает и должен так же непрерывно обновляться. А тяжелее всего приходится кроветворной ткани - красному костному мозгу. В особо тяжелых случаях, когда остановить опухоль могут только очень высокие дозы цитостатиков, эта ткань погибает полностью, и после выведения препарата из организма больному приходится пересаживать донорскую. Обычно же химиотерапию применяют курсами, между которыми делают длительные перерывы, чтобы дать организму возможность восстановиться. Понятно, что при этом передышку получают и уцелевшие опухолевые клетки, которым непрерывное размножение в сочетании с нестабильностью генома позволяет со временем приобрести устойчивость к применяемому препарату. Правда, современные химиотерапевтические препараты - так называемые таргетные - действуют уже не на все делящиеся клетки, а именно на раковые. Основой для них служат моноклональные антитела, способные узнавать свою мишень по особым белкам, которые у здоровых клеток либо отсутствуют вовсе, либо встречаются только на определенных стадиях эмбрионального развития. Беда, однако, в том, что среди множества раковых клеток непременно найдутся такие, у которых именно этих молекул нет. «Там есть уроды на все случаи жизни. Какой бы препарат мы ни применяли, всегда найдется десяток резистентных клеток. Они понемногу размножаются, и возникает опухоль, уже устойчивая к этому методу лечения», - говорит руководитель лаборатории методов скрининга канцерогенов НИИ канцерогенеза РОНЦ доктор медицинских наук Геннадий Белицкий.
Еще один фронт борьбы против рака наметился в 1971 году, когда американский медик Джуда Фолкмен обратил внимание на то, что быстрый рост опухоли и образование метастазов начинаются только после того, как внутрь новообразования прорастают кровеносные сосуды. В 1980-е годы исследователям удалось расшифровать химические сигналы, с помощью которых опухоли притягивают к себе капилляры, а в 1990-е сотрудник Фолкмена Майкл О’Рейли выделил и идентифицировал два вещества, подавляющих этот эффект. Преимущество ангиостатиков - препаратов, блокирующих рост сосудов, - в том, что они действуют не на злокачественные клетки, а на вполне здоровые клетки сосудов, у которых нет ни генетической нестабильности, ни бурного размножения, а потому эффективность такого лечения не снижается при его длительном применении. Кроме того, во взрослом здоровом организме нужда в прокладке новых капилляров возникает только при беременности или регенерации поврежденной ткани. Во всех остальных случаях применение ангиостатиков может повредить лишь опухоли, которая, лишившись кровоснабжения, не только прекращает рост, но словно бы усыхает до куда более скромных размеров.
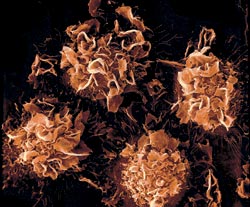 Форма раковых клеток разнообразна и порой бывает весьма причудлива, как у этих ворсинчатых клеток, возникающих при одной из разновидностей лейкемии |
| Рекомендовать » | Написать редактору | |
|
Распечатать »
|
Дата публикации: 06.12.2010 |
Дизайн и поддержка: Interface Ltd. |
|