Способ лечения онкологических заболеваний
Изобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении онкологических заболеваний. Способ включает введение цитостатиков и препарата на основе экзогенной ДНК человека в две фазы. При этом в первую фазу в течение первых одних-трех суток вводят пациенту цитостатик(и) и затем со следующих суток после окончания введения цитостатика(ов) и до 12 суток от его начала пациенту вводят препарат Панаген в форме таблеток или капсул, содержащих 5 мг активной субстанции, в количестве 6 таблеток/капсул в сутки, по одной каждые 3 часа в дневное время суток. Во второй фазе, следующей за первой, в течение восьми вводят препарат Панаген в количестве 3 таблетки/капсулы в сутки, по одной через каждые 6 часов в дневное время. Использование изобретения позволяет повысить 5-летнюю безрецидивную выживаемость пациентов до 50% за счет активации антигенпрезентирующих дендритных клеток и развития Т-клеточного адаптивного иммунного ответа в первой фазе терапии, а также активации мононуклеаров пейеровых бляшек мукозальной иммунной системы и повышения уровня лейкоцитов во второй фазе терапии. 1 з.п. ф-лы, 1 табл., 6 ил.
Изобретение относится к медицине и может быть использовано при комплексном лечении пациентов больных различными раками, где в схему лечения входит химиотерапевтическая процедура с использованием цитостатических препаратов, нарушающих структуру хроматина ядра и индуцирующих апоптоз раковых клеток.
Известны способы лечения различных типов раков, основанные на использовании монопрепаратов цитостатической группы таких как препарата цисплатин в дозе 100 мг/м2 (в виде одноразовой инъекции или дробно), препарата митомицин С в суммарной дозе 50 мг/м2, препарата дактиномицина в суммарной дозе 3000 мкг/м2, или высокодозовую химиотерапию фторурацилом [1-3].
Способы имеют относительно низкую эффективность лечения и связанную с этим ограниченность применения, ввиду того, что различные раки в различной степени чувствительны к монотерапии различным препаратами цитостатической группы.
К известным способам лечения раков относятся способы основанные на использовании комбинации препаратов цитостатической группы, как например эпирубицин 100 мг/м2 и циклофосфан 400 мг/м2 с поддержкой Г-КСФ [4, 5], доксорубицин 90 мг/м2 и циклофосфан 1000 мг/м2 при поддержке Г-КСФ [6].
Эти способы также имеют ограниченную применимость и относительно низкую эффективность, поскольку действие цитостатиков направлено исключительно на разрушение активно делящихся клеток как раковых, так и гемопоэтических и не предполагают какого-либо компенсирующего негативный эффект воздействия на организм.
Способы с использованием комбинации цитостатиков обладают крайне негативным действием на гемопоэз. При таких способах лечения не активируются адаптивные механизмы защиты от рака и лишь незначительно увеличивает безрецидивный интервал у больных раком [7, 8].
Известны также способы лечения, основанные на действии комбинации цитостатических препаратов и последующей иммунотерапией или использованием других факторов, например, серебра [9]. Сочетание химиотерапии с иммунотропными веществами, например, препаратом Ингарон, представляющим собой интерферон-гамма, может значительно снижать токсический и иммуносупрессивный эффект противоопухолевых препаратов [10]. Разрабатываются схемы с использованием цитостатических препаратов с последующей иммунотерапией специфическими олигонуклеотидами с фосфоротиоатным остовом и специфическим набором нуклеотидов (CpG) [11].
Основными недостатками указанных способов лечения онкологических заболеваний являются их ограниченное действие на системы организма, индуцирующие противораковый адаптивный иммунитет в случае использования различных цитокинов, и высокая токсичность с использованием препаратов на основе CpG олигонуклеотидов, не позволившая разработчикам провести доклинические испытания III фазы инъекционной формы препаратов.
Для компенсации негативного действия различных цитостатических схем полихимиотерапии применяют коррекцию гемопоэза лейкостимулирующими препаратами. В онкологической практике используются два принципиальных типа лейкостимуляторов. К первой группе относятся препараты на основе колонийстимулирующих факторов (Г-КСФ и ГМ-КСФ) которые мобилизуют стволовые клетки крови и активируют пролиферацию поздних предшественников нейтрофильного ростка кроветворения [12]. Вторая группа состоит из препаратов на основе нуклеиновых кислот, действие которых направлено на индукцию пролиферации предшественников всех ростков кроветворения разной степени коммитирования.
Использование препаратов на основе колониестимулирующих факторов в качестве стимуляторов кроветворения при лейкопениях, вызванных цитостатиками, является общепринятой практикой при лечении раков. Мобилизация клеток костного мозга под действием колоний - стимулирующих факторов, приводит к появлению в периферической крови всей гаммы форменных элементов лейкоцитарного и лимфоцитарного рядов. Насильственный выход в кровоток зрелых клеток в результате такого воздействия крайне болезнен и назначается при лейкопениях III-IV степени. В отличие от мобилизации стволовых клеток крови и их коммитированных потомков из стромальных ниш препаратами колониестимулирующего ряда, использование препаратов на основе нуклеиновых кислот для профилактики миелосупрессий является более щадящим способом стимуляции гемо- и лейкопоэза у онкологических больных.
Помимо указанных выше, известны способы лечения рака с использованием комбинации препаратов, одной составляющей из которых является препарат на основе нуклеиновой кислоты. Так, препарата Дезоксинат обладает антитоксическим и радиопротекторным действием и используется в качестве стимулятора лейкопоэза при химиолучевой терапии, проводимой у онкологических больных [13, 14]. Препарат ДНК, полученной из молок осетровых рыб, используется для стимуляции лейкопоэза у больных с запущенными формами опухолей органов брюшной полости путем однократного подкожного введения [15].
Используют также способ лейкостимуляции при лечении генерализованных опухолей путем внутримышечного или подкожного введения предварительно приготовленной смеси 5-фторурацила и Дерината. Способ позволяет повысить эффективность лечения за счет, сохранения концентрации цитостатика в опухолевой ткани [16].
Известен также способ, предполагающий использование трехкомпонентного конъюгата, состоящего из лейкостимулятора Дерината, антибиотика и белков крови, что позволяет депонировать антрациклиновые антибиотики внутримышечно или подкожно в неактивной форме продлевая, тем самым, эффект действия цитостатика [17].
Кроме того, описан способ использования препарата ДНК для лечения больных с запущенными формами опухолей органов брюшной полости путем внутримышечного введения смеси нативной ДНК и антрациклинового антибиотика, содержащей 5 мг антрациклинового антибиотика, растворенного в 4 мл растворителя, 75 мг ДНК и 2 мл 0,5% раствора новокаина и активации противоопухолевых клеток организма хозяина (CD 16 натуральных киллерных клеток) путем экстракорпорального подключения донорской свиной селезенки. Способ позволяет усилить эффект лечения больных с запущенными формами опухолей органов брюшной полости [18]. Также описан способ применения препарата экзогенной ДНК при лечении злокачественных новообразований, в сочетании с противоопухолевыми фитопрепаратами [19].
Кроме того, известно применение препарата ДНК в сочетании с Альфа-фетопротеином. Альфа-фетопротеин вводят подкожно, внутримышечно или внутривенно в разовой дозе 500-5000 МЕ/кг, а ДНК вводят внутримышечно в разовой дозе 0,5-4,0 мг/кг [20].
Все перечисленные способы обладают относительно низкой эффективностью лечения и следовательно имеют ограниченную применяемость, поскольку рассматривают в качестве терапевтической, лейкостимулирующее действие препаратов на основе нуклеиновых кислот в форме парентерального введения, которое мало эффективно при однократных инъекциях при развившихся лейкопениях и крайне токсично при многократных инъекциях, ввиду возможного развития патологических аутоиммунных состояний и индукции этой ДНК диссиминированного тромбоза сосудов, который ведет к системной воспалительной реакции и полиорганной недостаточности, что было подтверждено при проведении клинических исследований II фазы препаратов на основе CpG олигонуклеотидов. Низкая эффективность применения препаратов на основе нуклеиновых кислот в сочетании с другими противораковыми препаратами связана с отсутствием строгого знания о механизмах их синергичного действия. Помимо этого, ни один из приведенных способов применения препаратов ДНК не активирует противораковый адаптивный иммунитет организма.
Известны способы применения препарата ДНК человека Панаген (ЛСР №004429/08 от 09.06.2008), связанных с его противораковым, лейкостимулирующим, радиопротекторным действием [21-25]. Препарат Панаген содержит нативный, видоспецифичный фрагментированный нуклеопротеидный комплекс, состоящий из двуцепочечной ДНК человека и связанных с ней белков ядерного матрикса, что определяет спектр его терапевтических активностей [26]. Указанные способы применения препарата фрагментированной ДНК человека Панаген имеют ограниченную применимость, поскольку не учитывают в одной стратегии всю совокупность обнаруженных терапевтических свойств препарата, проявляющихся в сочетании с действием цитостатиков.
Наиболее близким по своей сущности к предложенному является способ лечения онкологических заболеваний [27], основанный на применении в схемах лечения рака молочной железы II-IV стадии препаратов цитостатической группы циклофосфана и доксорубицина и препарата на основе экзогенной ДНК человека Панаген, при этом, после однократного в рамках одного цикла химиотерапии пациенту вводят цитостатики: циклофосфан (500 мг/м2) и доксорубицин (50 мг/м2) (схема АС) или циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м2) (схема FAC) внутривенно, а также препарат Панаген в форме таблеток, покрытых гастроэнтерическим покрытием в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день через каждые два часа с началом приема с третьего дня после проведенной химиотерапии и продолжением приема препарата в течение 17 дней, и продолжением приема препарата по указанной схеме до окончания всех курсов химиотерапии.
Недостатком наиболее близкого технического решения является относительно узкая область применения, поскольку используется для лечения только одной нозологии - рака молочной железы и только для одной стандартной группы цитостатиков - фторурацил, доксорубицин и циклофосфан в регламентированных однозначных дозах. Кроме того, наиболее близкое техническое решение обладает относительно низкой эффективностью лечения, в том числе, от того, что препарат Панаген используется в известном способе в качестве лейкостимулятора, а не лейкопротектора, что является более эффективным, и, кроме того, не обеспечиваются оптимальные временные интервалы, когда препарат Панаген в синергизме с цитостатиками индуцирует адаптивный противораковый иммунитет или осуществляет лейкопротекорную функцию.
Известно, что химиотерапия применяется курсами. Это связано с попыткой эмпирически определить наиболее эффективный режим воздействия на опухоль, что, как следует из современного знания, связано с эрадикацией стволовых инициирующих клеток [28-36]. В подавляющем большинстве случаев курс химиотерапии составляет 21 и более суток после одно-трех разового введения цитостатиков [37]. Такие цифры связаны с эмпирически обнаруженным временем полного восстановления от циторедуцирующего воздействия, в пределах 1 месяца с минимальным интервалом 21 день [37, 38]. Цикл химиотерапии представлен двумя фазами. Фаза интенсивного действия, связанная со специфической активностью цитостатика, и фаза восстановления, то есть конец апоптотического разрушения клеток вследствие индукции цитостатиком программируемой гибели клеток. В фазе восстановления клетки входят в нормальный пролиферативный режим деления, что в клинической практике детектируется по восстановлению популяции клеток костного мозга [39]. Такой нормализованный режим характеризуется делением клеточного сообщества ККМ на три фазы G1/S/G2M в пропорции 60/25/15 [36, 40, 41]
Известно из литературных данных и показано в наших исследованиях, что действие цитостатика с одним из самых длинных репаративных циклов, циклофосфана, составляет 18-46 часов для раковых клеток и 24 часа для клеток стволовых клеток крови. Действие других цитостатиков имеет более короткий цикл воздействия [42, 43]. При этом последствия, а именно апоптотическое и вторично-некротическое разрушение обработанных раковых клеток и клеток костного мозга, продлеваются до 8-12 суток от начала обработки [32-36]. Именно это время и является первой фазой действия, которое характеризует активность любого цитостатика. Мы нашли, что к 12 суткам происходит полное восстановление нормального режима деления [36, 40, 41]. Также мы установили, что в клинике при лечении рака молочной железы, фаза восстановления гемопоэза начинается не позднее 14 дня от начала терапии [44], и к 21 дню гемопоэз полностью восстанавливается.
Именно такое понимание воздействия химиотерапии позволило классифицировать ее фазы и определить двойственное место препарата Панаген в химиотерапевтическом лечении рака.
Задачей, которая решается в изобретении, заключается в расширении арсенала технических средств, обеспечивающих повышение эффективности лечения онкологических заболеваний.
Требуемый результат заключается в расширении арсенала технических средств для лечения онкологических заболеваний и в повышении эффективности их лечения.
Поставленная задача решается, а требуемый технический результат достигается тем, что, в способе, основанном на применении при лечении препаратов цитостатической группы и препарата на основе экзогенной ДНК человека Панаген, согласно изобретению, лечение проводят в две фазы, на первой из которых осуществляют цитостатическое разрушение раковой опухоли и активацию дендритных клеток мукозальной иммунной системы пациента, для чего в течение первых одних-трех суток вводят пациенту цитостатик(и) и затем со следующих суток после окончания введения цитостатика(ов) и до 12 суток от его начала пациенту вводят препарат Панаген в форме таблеток или капсул, содержащих 5 мг активной субстанции, в количестве 6 таблеток/капсул в сутки, по одной каждые 3 часа в дневное время суток, а во второй фазе, следующей за первой, в течение восьми суток повышают уровень лейкоцитов, для чего вводят препарат Панаген в количестве 3 таблетки/капсулы в сутки, по одной через каждые 6 часов в дневное время.
Кроме того, требуемый технический результат достигается тем, что, препарат Панаген применяют в форме перорального лекарственного средства, активная субстанция которого или входит в состав таблетки с гастроэнтерическим покрытием или расфасована в кислотоустойчивые капсулы, растворяющиеся и распадающиеся в кишечнике при нейтральной рН окружающей среды, что необходимо для защиты активной субстанции препарата от апуринизации кислой агрессивной средой желудка, в количестве 6 таблеток/капсул в сутки в течение первой фазы и 3 таблеток/капсул в течение второй фазы терапии.
В более широком плане задачей настоящего изобретения является разработка обоснованного и экспериментально подтвержденного способа (стратегии) одновременного воздействия, в рамках процедуры лечения любого рака с применением однократного или многократных курсов программной полихимиотерапии, на опухолевую ткань, редуцируя ее развитие за счет активации дендритных клеток и индукции развития адаптивного иммунитета, и на организм пациента, помогая ему пережить негативные последствия действия мощных цитостатиков, которые используются в онкологической практике как основа лекарственного воздействия на раковые клетки, за счет протекции гемопоэтических предшественником костного мозга различной степени зрелости.
Требуемый результат достигается в способе, основанном на двухфазаной персонофицированной технологии активации адаптивного противоракового иммунного ответа и оказания лейкопротекорного действия в схемах лечения раков любой этиологии, где назначается химиотерапия с применением различных цитостатиков, в том числе цитостатиков кросслинкирующего ряда (митомицин С, циклофосфан, цисплатин и др), препаратом на основе двуцепочечной ДНК Панаген, основанная на принципе темпоральной координации разрушения раковой опухоли цитостатиком и, как следствие, появлением в периферических жидкостях раковоклеточного дебриса (читай всей совокупности раковых антигенов) и одновременной активации препаратом двуцепочечной ДНК Панаген дендритных клеток мукозальной иммунной системы, расположенных в пейеровых бляшках и солитарных фолликулах верхнего и среднего отделов кишечника, в результате чего происходит праймирование дендритных клеток мукоза и индукция пролиферации лимфоцитарных клонов, формирующих пул СD8+перфорин+ цитотоксических лимфоцитов-киллеров целевых опухолевых клеток в течение первых 12 дней от начала введения препарата цитостатического ряда (первая фаза), и продолжением приема препарата Панаген до 20 суток от начала терапии уже в качестве мощного лейкопротекторного, гепатопротекторного и адаптогенного средства (вторая фаза), отличного по механизму действия от лейкостимулирующего действия препаратов колониестимулирующего ряда.
На чертеже представлены.
Фиг. 1 - эффект активации дендритных клеток препаратом Панаген. 1,а - стимуляция созревания ДК здоровых доноров, генерированных в присутствии ЛПС или препарата ДНК в количестве 5 мкг/мл. Приведены индексы влияния, выражающие отношение процента дендритных клеток с соответствующим поверхностным маркером к аналогичному значению у клеток, генерированных без дозревающего стимула, принятому за единицу. 1,б - стимуляция созревания дендритных клеток в костном мозге мышей после обработки животных только цитостатиком циклофосфаном или циклофосфаном и препаратом ДНК. Мыши получали инъекции циклофосфана в дозе 200 мг/кг веса и препарата ДНК в дозе 0,2 мг в день инъекции цитостатика и на 3, 4, и 5 сутки после циклофосфана. Приведено процентное содержание дендритных клеток среди клеток костного мозга относительно исходного уровня у мышей до обработок, принятого за 100%.
Фиг. 2 - разрушение раковых клеток после воздействия цитостатика. 2,а - жизнеспособность клеток асцита Кребс-2, выделенного из животных, обработанных циклофосфаном и препаратом ДНК по сравнению с контрольными асцитными клетками без обработок. На верхней панели представлены графики проточной цитометрии с процентом жизнеспособных клеток, на нижней панели приведен микроскопический анализ клеток. 2,б - электофоретическая картина апоптоза с выраженной фрагментацией нуклеосомной ДНК, выделенной из асцитной жидкости на 3-й день после обработки мышей циклофосфаном и препаратом ДНК. 2,в - анализ клеточного цикла клеток асцита Кребс-2 после трехкратной обработки мышей цитостатиком циклофосфаном в дозе 100 мг/кг веса с интервалом 36 ч. Обнаруживается апоптоз клеток асцита через 90 ч после начала обработок по сравнению с контрольными клетками асцита без обработок. 2,г - анализ клеточного цикла клеток гепатомы Г-29 после шестикратной обработки мышей цитостатиком циклофосфаном в дозе 50-100 мг/кг веса. Обнаруживается апоптоз клеток на 7 сутки после начала обработок по сравнению с контрольными клетками асцита без обработок.
Фиг. 3 - появление СD8+перфорин+ Т-цитотоксических лимфоцитов при воздействии препаратом Панаген. 3,а - содержание СD8+перфорин+ Т-клеток после инкубации мононуклеарных клеток с дендритными клетками, созревшими в присутствии различных дозревающих стимулов (0 - без дозревающего стимула, ЛПС - липополисахарид из стенки бактерий и ДНК). Приведен индекс влияния - отношение процентного содержания СD8+перфорин+ Т-клеток в экспериментальных образцах к процентному содержанию СD8+перфорин+ Т-клеток в интактных мононуклеарных клетках, принятому за единицу. * - достоверное отличие от интактных мононуклеарных клеток, р<0,05, критерий Вилкоксона-Манна-Уитни. 3,6 -относительное содержание СD8+перфорин+ Т-клеток в периферической крови пациентов после проведения II фазы клинических испытаний препарата Панаген с химиотерапией по схемам FAC или АС на 21 день после первого курса химиотерапии. Приведены значения относительно исходного уровня, принятого за 100%. Группа, принимающая препарат Панаген, разделена на две части, те, у кого проявлялся эффект увеличения содержания СD8+перфорин+ Т-клеток и нет, n - количество пациентов в каждой группе. Приведены медианы (маленький квадрат), квартальные диапазоны 25-75% (прямоугольники) и минимум-максимум диапазоны. * - достоверное отличие от группы Плацебо, р<0,05, критерий Вилкоксона-Манна-Уитни.
Фиг. 4 - циторедуцирующий эффект воздействия цитостатической обработки, приводящей к разрушению белого ростка кроветворения. 4,а - анализ апоптоза клеток костного мозга, выделенных из мышей после инъекций циклофосфана (200 мг/кг веса) и препарата ДНК человека по 0,5 мг четырехкратно с интервалом в один час с 18 ч до 21 ч после введения циклофосфана, по сравнению с контрольным образцом без обработок. 4,б - частота выявления нейтропений I-IV степени на 14 день после 3 химиотерапии у пациентов, участвовавших во II фазе клинических исследований препарат Панаген, на фоне химиотерапии по схемам FAC или АС.
Фиг. 5 - лейкопротекторный эффект действия препарата Панаген. 5,а - схематическое изображение динамики изменения количества лейкоцитов в периферической крови пациентов, участвовавших во II фазе клинических исследований препарата Панаген на фоне химиотерапии по схемам FAC и АС. 5,б - изменение неспецифической цитотоксической активности мононуклеарных клеток периферической крови у пациентов, участвовавших во II фазе клинических исследований препарата Панаген, на 21 сутки после трех последовательных химиотерапий по схеме FAC. Цитотоксическую активность мононуклеаров оценивали против клеток аллогенной опухолевой линии MCF-7 в МТТ-тесте при соотношении клеток-эффекторов и клеток-мишеней 5:1. Процент цитотоксичности рассчитывали по формуле: [1 - (оптическая плотность в культурах с эффекторными клетками / оптическая плотность в контрольных культурах в отсутствие эффекторных клеток)] × 100%. Данные представлены в виде медианных значений, квартального диапазона 25-75% и минимум-максимум диапазона.
Фиг. 6 - влияние препарата Панаген на синтез цитокинов у пациентов, проходящих II фазу клинических исследований препарат Панаген с химиотерапией по схемам FAC или АС на 21 день после первого и третьего курса химиотерапии (ХТ1 и ХТ3) по сравнению с состоянием до начала исследования (0). Приведена спонтанная и митоген-активированная секреция цитокинов при FAC режиме химиотерапии в группе плацебо (n=4) и Панаген (n=12) и при АС режиме химиотерапии в группе плацебо (n=6) и Панаген (n=19). Результаты были проанализированы One Way Repeated Measures и двухсторонним ANOVA с постходовыми испытаниями Холма-Сидака и Туки, чтобы оценить значимость интервально-зависимых изменений, а также разницу между группами. Абсолютные единицы измерения (пг/мл) были преобразованы в натуральные логарифмы для нормализации данных. Данные представлены как среднее ± SEM; a, b - статистически значимое различие (р<0,05) против 0 или ХТ1 соответственно; с - статистически значимое различие (р<0,05) между группами Панаген и плацебо.
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Сущность предложенного технологии заключается в двухфазном приеме препарата Панаген в ходе нескольких последовательных циклов програмной полихимиотерапии. На первой фазе осуществляют цитостатическое разрушение раковой опухоли и проводят активацию дендритных клеток мукозальной иммунной системы пациента, для чего в течение первых одних-трех суток вводят пациенту цитостатик(и) и затем со следующих суток после окончания введения цитостатика(ов) и до 12 суток от его начала пациенту вводят препарат Панаген в форме таблеток или капсул, содержащих 5 мг активной субстанции, в количестве 6 таблеток/капсул в сутки, по одной каждые 3 часа в дневное время суток, а во второй фазе, следующей за первой, в течение восьми суток повышают уровень лейкоцитов, для чего вводят препарат Панаген в количестве 3 таблетки/капсулы в сутки, по одной через каждые 6 часов в дневное время.
Первая фаза приема позволяет активировать адаптивный иммунный противораковый ответ, вторая фаза приема препарата Панаген позволяет провести защиту белого ростка кроветворения от действия цитостатических препаратов и обусловить его быстрое восстановление.
Технология может быть применена при лечении различных раков в случае использования расписания введения цитостатиков, при котором циторедуцирующие препарат или препараты вводятся или в одно время, или на протяжении определенного промежутка времени, но не более, чем в течение трех дней от первой инъекции первого цитостатика.
В целом предложенный способ основан на двух независимых типах воздействия препарата на основе двуцепочечной ДНК человека Панаген на две популяции клеток мукозальной иммунной системы.
Первый из них связан с воздействием препарата Панаген на дендритные клетки мукоза во время циторедуцирующего действия на опухоль кросслинкирующего или иного цитостатика.
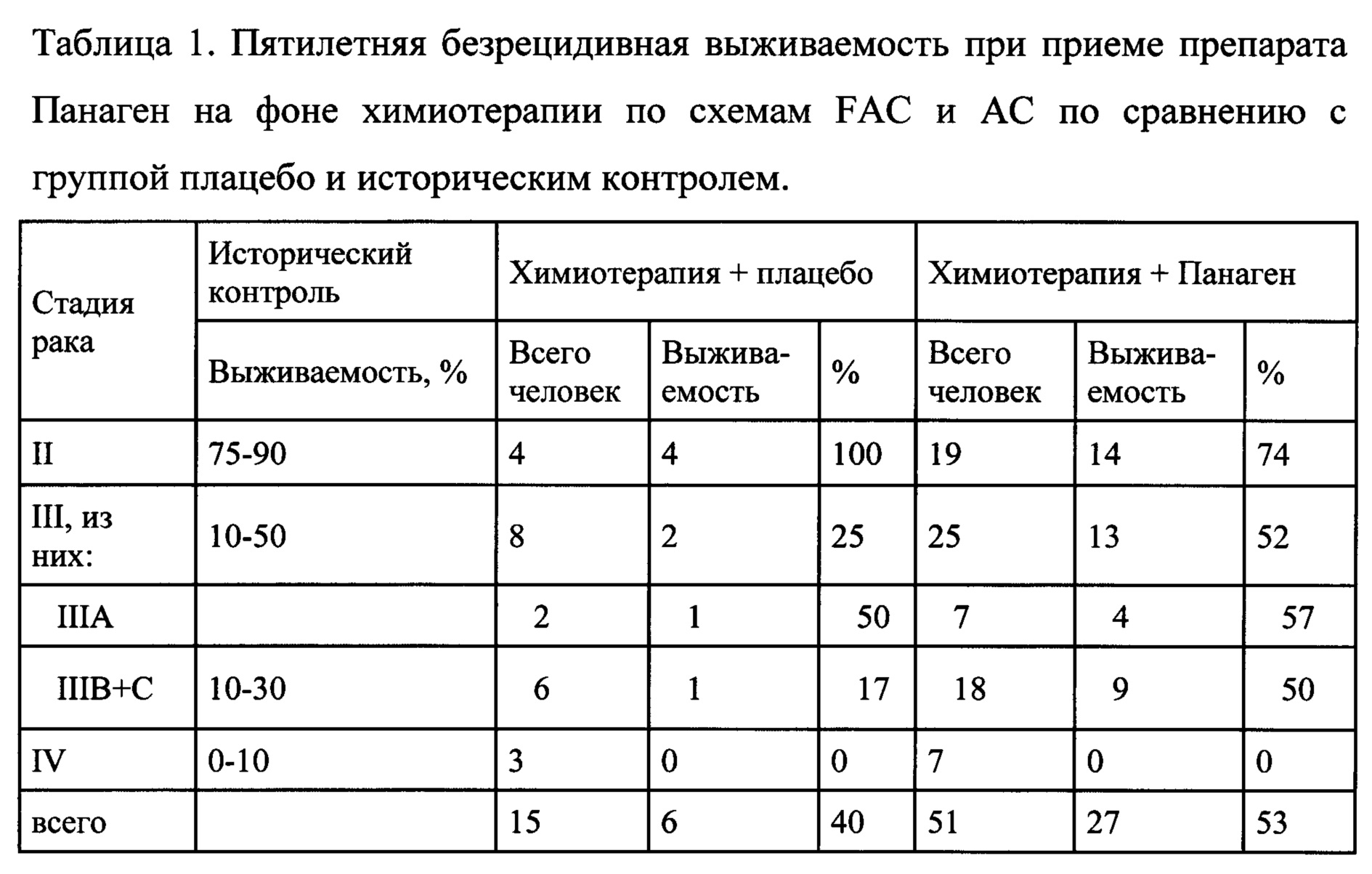
При обработке химиотерапевтическими агентами происходит разрушение раковых клеток вследствие индуцированного апоптоза и развившегося вторичного некроза, причем пик такого разрушения приходится на 5-9 сутки от начала терапии цитостатиками (фиг. 2). В этот промежуток времени в организме в большом количестве появляется дебрис погибших раковых клеток, представляющий полный набор антигенов персонального рака. В первую фазу химиотерапии после инъекций цитостатиков в течение одних-трех суток при приеме препарата Панаген со следующих суток после окончания введения цитостатика и до 12 суток от начала химиотерапии в количестве 6 таблеток или капсул в сутки, содержащих 5 мг активной субстанции, по одной каждые 3 часа в течение дневного времени суток, в организме пациента одновременно с появлением антигенного материала разрушенных клеток персонального рака, за счет действия препарата Панаген активируются антигенпрезентирующие дендритные клетки. Эти клетки поглощают раковоклеточный дебрис, процессируют поглощенный материал и после встречи с незрелым Т лимфоцитом паракринно активируют клональную пролиферацию (фиг. 1). Такая активность приводит к формированию в периферическом кровяном русле пула CD8+перфорин+ Т цитотоксических лимфоцитов, направленных на киллинг клеток персональной опухоли, которые детектируются на 21 день после первого введения цитостатического препарата (фиг. 3). То есть развивается Т-клеточный адаптивный иммунный ответ. Результатом такого терапевтического подхода является увеличение 5-летней безрецидивной выживаемости пациентов (на примере рака молочной железы IIIC) до 50%, при историческом контроле 20% и показателей группы плацебо 17% (таблица 1).
Второй тип воздействия препарата Панаген связан с активацией активной субстанцией препарата Панаген мононуклеаров пейеровых бляшек мукозальной иммунной системы во вторую фазу терапии между 13 и 20 сутками от первой инъекции цитостатика во время максимального падения всех показателей белого ростка кроветворения на 14 сутки каждого цикла химиотерапии, часто проявляющегося в лейкопениях различной степени тяжести (фиг. 4).
Введение в этот промежуток времени в терапию препарата Панаген в количестве 3 таблеток или капсул в сутки, содержащих 5 мг активной субстанции, по одной каждые 6 часов в течение дневного времени суток, приводит к активации мононуклеаров мукозальной иммунной системы, расположенных в зоне кэпинга пейеровых бляшек верхнего и среднего отделов кишечника. Активированные мононуклеары уходят на периферию и за счет секреции специфической палитры цитокинов (Фиг. 6) активируют пролиферацию клеток белого кроветворного ростка в костном мозге и их ближайших комметированных потомков в кровяном русле, что позволяет в кротчайшее время поднять цифровые показатели периферической крови пациентов до значений, позволяющих проводить последующую химиотерапию без смещения расписания, вследствие индуцированной цитостатиками лейкопении (фиг. 5).
Прием препарата Панаген в течение обеих фаз химиотерапевтической процедуры приводит к затиханию цитокинового шторма, как правило, индуцированного в организме пациента возникшим заболеванием (фиг. 6).
Такой эффект приводит к существенному улучшению показателей качества жизни по шкалам (на примере рака молочной железы).
В современной литературе отсутствуют указания на предлагаемую технологию воздействия на персонифицированные раки.
Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает критерию практической (промышленной) применимости.
Рассмотрим теоретическое и экспериментальное доказательства базовых положений технологии.
Рассмотрим основные положения способа и приведем доказательства их применимости к реализации рассматриваемой технологии.
Способ основан на двух независимых типах воздействия препарата на основе двуцепочечной ДНК человека Панаген на две популяции клеток мукозальной иммунной системы.
Первый тип воздействия препарата Панаген осуществляется на дендритные клетки мукоза во время циторедуцирующего действия на опухоль кросслинкирующего или иного цитостатика. При обработке химиотерапевтическими агентами происходит разрушение раковых клеток вследствие индуцированного апоптоза и развившегося вторичного некроза, причем пик такого разрушения приходится на 5-9 сутки от начала терапии цитостатиками. В этот промежуток времени в организме в большом количестве появляется дебрис погибших раковых клеток представляющий полный набор антигенов персонального рака, причем в это же время дендритные клетки восстанавливают свою антигенпрезентирующую активность, блокированную агрессивным гуморальным воздействием опухоли под воздействие препарата Панаген
Рассмотрим эффект активации дендритных клеток препаратом Панаген в различных экспериментальных системах.
Установлено, что препарат Панаген активирует дендритные клетки различных организмов как в системе in vitro, так и in vivo (Фиг. 1). На мышах показано, что инъекции препарата Панаген стимулируют активацию антигенпрезентирующих свойств дендритные клеток, что проявляется в изменении маркеров зрелости. Количество зрелых CD34-CD80+ дендритных клеток среди клеток селезенки и костного мозга мышей достигает максимума на 3 сутки после обработки препаратом Панаген. Поверхностный маркер CD83 регулирует развитие CD4+ Т-клеток. Обработка цитостатиками доксорубицином и циклофосфаном приводит к повышению экспрессии поверхностного маркера зрелых дендритных клеток CD83 до 0,5% относительно нулевого уровня в контрольной группе. Уровень экспрессии поверхностного CD83 достигает 5% при дополнительных инъекциях животным препарата Панаген (Фиг. 1).
Показано, что препарат Панаген усиливает созревание и стимулирующую активность генерируемых in vitro из моноцитов дендритных клеток человека. Известно, что зрелые дендритные клетки отличаются от незрелых более высоким уровнем экспрессии маркера зрелости CD83, костимуляторных молекул (CD86, CD80), молекулы гистосовместимости 11-го класса HLA-DR и более низкой экспрессией маркера незрелости CD 14. Как следует из Фиг. 1, ЛПС-активированные клетки отличались от интактных дендритных клеток большей долей и средней интенсивности флуоресценции CD83, CD86, HLA-DR и меньшими показателями экспрессии CD 14. При сравнении с ЛПС в качестве стандартного индуктора созревания (позитивный контроль) стимуляция дендритных клеток препаратом Панаген приводила к аналогичным изменениям фенотипа. Таким образом, препарата Панаген аналогично классическому стандартному активатору ЛПС оказывает четкий стимулирующий эффект на созревание дендритных клеток.
Согласно данным литературы зрелые дендритные клетки обладают более высокой способностью стимулировать пролиферацию аллогенных Т-клеток в смешанной культуре лимфоцитов. Это подтверждается данными на фиг. 1. Пролиферативный ответ аллогенных мононуклеарных клеток в смешанных культурах лимфоцитов, индуцированных ЛПС-активированными дендритными клетками был в 2 раза выше, чем в культурах смешанных культурах лимфоцитов, индуцированных нестимулированными дендриттными клетками. Аллостимуляторная активность дендритных клеток, созревание которых индуцировалась активной субстанцией препарата Панаген, была также 2-кратно выше, чем у нестимулированных дендритных клеток. Таким образом, препарат Панаген в системе ex vivo обладает способностью усиливать аллостимуляторную активность дендритных клеток. Причем по выраженности стимулирующего эффекта не отличаются от действия классического стандартного индуктора ЛПС.
В клиническом применение считается, что если в периферическом русле появляется увеличенное количество CD123 или CD11 дендритных клеток, то это свидетельствует о зрелом состоянии антгенпрезентирующих клеток. Было показано, что при введении в химиотерапевтическую обработку пациентов, проходящих химиотерапии по поводу рака молочной железы препарата Панаген, в плазме крови таких пациентов обнаруживается высокий процент CD123 и CD11 дендритных клеток, что коррелирует с положительным прогнозом лечения.
Рассмотрим примеры, определяющие время разрушения раковых клеток на 3-9 сутки от первой инъекции цитостатика.
В активации адаптивного иммунного ответа первостепенное значение имеют два обстоятельства. Первое, это активность антигенпрезентирующих дендритных клеток и второе, наличие специфического (в нашем случае ракового(ых) антигена(ов)). Нами было установлено, что апоптотическая деградация раковых клеток в результате действия цитостатика начинается на 3-5 сутки от первой инъекции химиотерапевтического препарата и заканчивается к 9 суткам масштабным вторичным некрозом при избытке опухолевой ткани и недостатке макрофагов. Именно в этот промежуток времени активные дендритные клетки будут захватывать сформированный раковоклеточный дебрис и выполнять свою антигенпрезентирующую функцию. В различных экспериментах в различных опухолевых системах были определены временные параметры начала и окончания процесса разрушения раковых клеток. Так для клеток асцита карциномы Кребс-2 окончание разрушения клеток приходится на 9 сутки от начала обработок. Для клеток гепатомы Г-29 разрушение продолжается до 7 суток от начала обработок. Для клеток лимфосаркомы RLS, устойчивой к действию циклофосфана, активное разрушение раковых клеток приходится на 6-9 сутки от начала терапии (Фиг. 2). Это означает, что если в это время в организме присутствуют зрелые активированные дендритные клетки, способные захватывать появившийся в периферических жидкостях раковые антигены в виде раковоклеточного дебриса, то с неизбежностью будет развиваться специфический персонифицированный противораковый адаптивный иммунный ответ.
В первую фазу химиотерапии после инъекций цитостатиков в течение одних-трех суток при приеме препарата Панаген со следующих суток после окончания введения цитостатиков и до 12 суток от начала химиотерапии в количестве 6 таблеток или капсул в сутки, содержащих 5 мг активной субстанции, по одной каждые 3 часа в течение дневного времени суток, в организме пациента одновременно с появлением антигенного материала разрушенных клеток персонального рака, за счет действия препарата Панаген активируются антигенпрезентирующие дендритные клетки. Эти клетки поглощают раковоклеточный дебрис, процессируют поглощенный материал и после встречи с незрелым Т лимфоцитом паракринно активируют клональную пролиферацию. Такая активность приводит к формированию в периферическом кровяном русле пула CD8+перфорин+ Т цитотоксических лимфоцитов, направленных на уничтожение клеток персональной опухоли, которые детектируются на 21 день после первого введения цитостатического препарата. То есть развивается Т клеточный адаптивный иммунный ответ. Результатом такого терапевтического подхода является увеличение 5-летней безрецидивной выживаемости пациентов (на примере рака молочной железы IIIC) до 50%, при историческом контроле 20% и показателей группы плацебо 17%.
Рассмотрим экспериментальные и клинические доказательства индукции развития адаптивного иммунного ответа препаратом Панаген, выражающегося в появлении CD8+перфорин+ Т цитотоксических лимфоцитов на различных экспериментальных и клинических моделях.
Эффективность генерации цитотоксических Т-клеток в процессе противоопухолевого ответа во многом определяется функциональной активностью дендритных клеток, презентирующих опухолевые антигены. Развитие опухоли, как правило, ассоциировано с уменьшением количества дендритных клеток и нарушением их функций, в том числе вследствие задержки их созревания, что может обусловливать низкую эффективность антигенспецифического противоопухолевого иммунного ответа [45]. Полученные данные свидетельствуют, что стимуляция дендритных клеток двуцепочечной фрагментированной ДНК человека (препарат Панаген) повышает их способность к активации Т-клеток и превращения их в специализированные Т-цитотоксические лимфоциты.
Активация адаптивного иммунного ответа при обработке препаратом Панаген была исследована на мышиной модели, на культуре клеток человека и в клиническом применении.
В исследованиях на мышах был проведен анализ количества перфорин-содержащих CD8+ цитотоксических лимфоцитов в суспензии клеток из всех органов. Оказалось, что инъекции препарата ДНК на фоне инъекций цитостатиков доксорубицина и циклофосфана приводят к увеличению количества CD8+ цитотоксических лимфоцитов до 16,5% относительно контроля (6,6%), повышая также уровень внутриклеточного, токсичного для клеток опухоли белка перфорина до 52,8%, против 21,7% в контроле. Эксперименты, выполненные на мышах, предполагают, что инъекции мышам с привитыми опухолями препарата ДНК на фоне инъекций цитостатиков циклофосфана и доксорубицина приводит к развитию у животных адаптивного иммунитета, который проявляется в созревании антиген-презентирующих клеток, в частности дендритных, и активации ими пролиферации пула цитотоксических перфорин-содержащих CD8+ Т-лимфоцитов. Развившийся адаптивный иммунный ответ влияет на развитие экспериментальных опухолей мыши, что проявляется в торможении роста графта.
В экспериментах ex vivo выполненных на культуре клеток человека были получены аналогичные результаты.
Было проведено несколько серий экспериментов. Оценивалась способность интактных и обработанных препаратом Панаген дендритных клеток стимулировать генерацию цитотоксических Т-клеток. В одной серии экспериментов у 7 доноров генерировали дендритные клетки в отсутствие и в присутствии препарата Панаген. В качестве позитивного контроля для стимуляции созревания дендритных клеток использовали стандартный стимул - ЛПС. Затем полученные дендритные клетки использовали в качестве стимуляторов в смешанной культуре лимфоцитов. Через 48 ч в культуре смешанной культуре лимфоцитов оценивали количество цитотоксических CD8+ Т-лимфоцитов с внутриклеточным содержанием перфорина. Количество CD8+перфорин+ Т-клеток среди свежевыделенных отвечающих мононуклеарных клеток служило контролем. Как следует из полученных данных, свежевыделенные мононуклеарные клетки доноров характеризовались низким содержанием CD8+перфорин+ Т-клеток (3,2±0,26%). Незрелые дендритные клетки индуцировали в смешанной культуре лимфоцитов достоверное 3-кратное увеличение относительного количества цитотоксических Т-лимфоцитов. Обработка дендритных клеток стандартным дозревающим стимулом - ЛПС - только в 2 из 7 случаев (доноры №2 и №6) приводила к незначительному усилению их способности активировать цитотоксические Т-клетки. В то же время использование в качестве дозревающего стимула препарата Панаген оказывало более выраженный эффект, в результате которого дендритные клетки 6 из 7 обследованных доноров (кроме донора №3) повысили свою способность к активации CD8+перфорин+ Т-клеток. Таким образом, дендритные клетки характеризуются способностью к активации цитотоксических Т-лимфоцитов, экспрессирующих внутриклеточно перфорин. При этом, данная функциональная активность дендритных клеток может быть дополнительно усилена при использовании в качестве дозревающего стимула фрагментированной ДНК человека (препарат Панаген), тогда как ЛПС оказывает менее значимый стимулирующий эффект.
В отдельной серии экспериментов было проведено исследование способности активной субстанции препарата Панаген индуцировать цитотоксическую активность CD8 Т-клеток по экспрессии CD107а молекулы на Т-клетках в смешанной культуре лимфоцитов. CD107a молекула входит в состав мембраны цитотоксических гранул и отсутствует на поверхности покоящихся CD8+ Т-клеток. При дегрануляции CD8+ Т-клеток происходит слияние мембраны гранул с цитоплазматической мембраной, в результате чего CD107a появляется на поверхности CD8+ Т-клеток. Соответственно количество CD8+ CD107a+ клеток отражает долю функционально активных цитотоксических Т-клеток.
Чтобы убедиться, что зрелые ДК более эффективно индуцируют генерацию Т-цитотоксических лимфоцитов, в предварительных экспериментах сравнили способность нестимулированных и ЛПС-стимулированных дендритных клеток индуцировать возрастание доли CD8+ CD107a+ клеток в смешанной культуре лимфоцитов по сравнению с их содержанием среди свежевыделенных мононуклеарных клеток. Показано, что дендритные клетки, культивируемые без дозревающего стимула, не стимулируют прироста CD8+107a+клеток в смешанной культуре лимфоцитов по сравнению с содержанием этих клеток в популяции свежевыделенных мононуклеарных клеток. В то же время ЛПС-стимулированные дендритные клетки индуцировали возрастание доли CD8+107a+ в смешанной культуре лимфоцитов по сравнению с их уровнем в популяции свежевыделенных мононуклеарных клеток.
Сравнение в последующей серии экспериментов эффектов ЛПС и препарата Панаген на способность дендритных клеток индуцировать в смешанной культуре лимфоцитов функционально активные Т-цитотоксические лимфоциты показало, что активированные препаратом Панаген дендритные клетки индуцировали в смешанной культуре лимфоцитов 2-кратно большее количество CD8+ CD107a+ Т-цитотоксических лимфоцитов по сравнению с нестимулированными дендритными клетками. Таким образом, стимулирующее действие препарата Панаген по силе эффекта на дендритные клетки превосходит эффект действия ЛПС. Представленные данные подтверждают, что препарат Панаген стимулирует созревание дендритных клеток, усиливает их аллостимуляторную активность и способность дендритных клеток индуцировать генерацию цитотоксических Т-клеток (Фиг. 3).
При клиническом применении препарата Панаген была проведена оценка количества перфорин-содержащих Т-цитотоксических лимфоцитов в периферической крови пациентов, больных раком молочной железы, находящихся в рамках клинических исследований препарата Панаген. Существенное достоверное увеличение содержания CD8+перфорин+ Т-цитотоксических лимфоцитов в периферической крови по сравнению с показателями группы «плацебо» на 21 день после 1 химиотерапии наблюдалось у 58% пациентов, получавших химиотерапию по схеме FAC (7 из 12), и у 16% пациентов, получавших химиотерапию по схеме АС (3 из 19) (Фиг. 3). Этот факт свидетельствует о том, что препарат Панаген в сочетании со стандартными химиотерапевтическими процедурами по схемам FAC и АС активирует развитие адаптивного иммунного ответа.
Рассмотрим эффект противораковой активности препарата Панаген. Оценим 5 летнюю безрецидивную выживаемость при приеме препарата Панаген.
Чтобы определить, коррелирует ли определяемая противораковая активность инъекций препарата Панаген с появлением в организме мышей CD8+перфорин+ лимфоцитов была проведена серия экспериментов с использованием стратегии сочетания воздействия цитостатиков и препарата ДНК на развивающуюся и развитую экспериментальную опухоль, достигшую измеряемых размеров.
Продемонстрировано, что если количество опухолевых клеток не превышает 300 тыс., то развивающийся иммунный ответ в состоянии практически полностью предотвратить развитие перевитого графта. На модели опухоли Кребс-2 на 16 сутки в группе «доксорубицин + циклофосфан + ДНК» только одна мышь из 10 имела пальпируемую опухоль. В случае же с опухолью, достигшей измеряемых размеров (1 см3), синергичное действие трех препаратов останавливает рост опухоли. Проведенный анализ показал, что такая опухоль как Кребс-2, достигшая измеряемых размеров, которая устойчива к действию как циклофосфана, так и доксорубицина, в случае примененной стратегии тормозится в развитии. К 25 суткам наблюдения размер опухоли не превысил 1 см3, который был зафиксирован на момент начала терапии. Оказалось, такая схема обеспечивает высокий уровень торможения роста опухоли и на другой экспериментальной модели. Скорость роста слабо иммуногенной, резистентной к алкилирующим цитостатикам опухоли RLS более чем в 2,5 раза отличалась от скорости роста опухоли в контроле.
Появление в иммунокомпетентных органах экспериментальных животных зрелых форм ДК и увеличение количества цитотоксических перфорин-содержащих лимфоцитов свидетельствует о том, что проведенная обработка индуцировала развитие в организме мышей противоракового адаптивного иммунного ответа. На это также указывают результаты, свидетельствующие, что мононуклеары периферической крови мышей с перевитой опухолью Кребс-2, обработанных циклофосфаном, доксорубицином и препаратом ДНК человека, проявляют высокую цитотоксическую активность по отношению к асцитным клеткам опухоли графта.
Была оценена противораковая активность препарата Панаген в клиническом применении по продолжительности безрезидивного периода у пациентов, участвовавших в клинических исследованиях препарата Панаген по поводу рака молочной железы. На протяжении пяти лет после проведенного лечения осуществлялось наблюдение за состоянием пациентов, принимавших участие в клинических испытаниях препарата Панаген. Все пациенты получали полный курс химиотерапии по схемам FAC и АС с последующим назначением тамоксифена в случае гормонзависимого типа рака. Была оценена 5-летняя безрецидивная выживаемость пациентов, участвующих в исследовании, как показатель противоракового действия препарата (таблица 1). Показано, что общая 5-летняя безрецидивная выживаемость составляет: для группы плацебо (n=15) - 40%, для группы Панаген (n=51) - 53%. Выживаемость для пациентов с IIIB и IIIC стадиями заболевания, характеризующимися прорастанием опухоли в стенку грудной клетки либо кожу и метастазами в региональные лимфоузлы, имеющими весьма неблагоприятный прогноз, для группы плацебо (n=6) составляет 17%, что соответствует данным мировых исследований. При применении препарата Панаген безрецидивная выживаемость пациентов с этими стадиями рака молочной железы (n=18) составила 50%, что почти в 3 раза выше аналогичного показателя в контрольной группе.
Второй тип воздействия препарата Панаген связан с активацией активной субстанцией препарата Панаген мононуклеаров пейеровых бляшек мукозальной иммунной системы во вторую фазу терапии между 13 и 20 сутками от первой инъекции цитостатика во время максимального падения всех показателей белого ростка кроветворения на 14 сутки каждого цикла химиотерапии, часто проявляющегося в лейкопениях различной степени тяжести.
Рассмотрим циторедуцирующий эффект воздействия цитостатической обработки, приводящей к разрушению белого ростка кроветворения.
Циторедуцирующее действие цитостатиков затрагивает любые активно делящиеся клетки организма, как раковые в случае злокачественного новообразования, так и гемопоэтические стволовые клетки и первый эшелон комметированных потомков. При проведении клинических исследований препарата Панаген было выявлено, что максимальное падение всех количественных показателей крови и развития нейтропений различной силы тяжести наблюдается на 14 сутки от начала химиотерапии (фиг. 4).
Введение в этот промежуток времени в терапию препарата Панаген в количестве 3 таблеток или капсул в сутки, содержащих 5 мг активной субстанции, по одной каждые 6 часов в течение дневного времени суток, приводит к активации мононуклеаров мукозальной иммунной системы, расположенных в зоне кэпинга пейеровых бляшек верхнего и среднего отделов кишечника. Активированные мононуклеары уходят на периферию и за счет секреции специфической палитры цитокинов, активируют пролиферацию клеток белого кроветворного ростка в костном мозге и их ближайших комметированных потомков в кровяном русле, что позволяет в кратчайшее время поднять цифровые показатели периферической крови пациентов до значений, позволяющих проводить последующую химиотерапию без смещения расписания вследствие индуцированной цитостатиками лейкопении.
Рассмотрим лейкопротекторный эффект действия препарата Панаген в клиническом применении.
Были выполнены исследования лейкопротеткторного действия препарата Панаген в ходе последовательного проведения трех химиотерапий с использованием схемы FAC и АС по поводу рака молочной железы II-IV. Главной задачей исследования было определить эффект влияния препарата на гемопоэтические ростки в нарастающей прогрессии негативного действия нескольких проводимых подряд химиотерапий. В этой связи два обобщенных параметра были необходимы для оценки действия препарата. Первый - достоверность отличий числа форменных элементов определенного ростка кроветворения в периферической крови в контролируемых точках после проведения 1, 2 и 3 химиотерапии у пациентов, принимавших Панаген, в сравнении с пациентами, принимавшими плацебо. При этом предполагалось, что эффект стимуляции поэза будет доказан, если хотя бы в одной из контрольных точек будут обнаружены достоверные различия в значениях показателей количества форменных элементов крови. Такой подход диктовали следующие факторы: 1) полное отсутствие в научной литературе информации о временных режимах (реперных точках) оценки стимуляции поэза форменных элементов крови через гастро-энтерический тракт, что определило произвольный выбор контрольных точек; 2) быстрая миграция из периферического русла нейтрофилов к местам их функционирования, что также создавало трудности в фиксации стимуляции пролиферации этих элементов крови по оценке их количества в периферической крови.
Второй - динамика изменения числа форменных элементов основных ростков кроветворения в периферической крови в контрольных точках 1, 2 и 3 химиотерапии в двух сравниваемых группах («Панаген» и «плацебо»). Также важными параметрами были оценка частоты возникновения нейтропений I-IV степени по ходу проведения химиотерапий
В результате проведенного исследования были охарактеризованы следующие терапевтические свойства препарата Панаген, выявляемые по ходу проведения трех последовательных химиотерапий по схемам FAC и АС.
В проведенном исследовании установлено, что абсолютное значение лейкоцитов, нейтрофилов и моноцитов, в контрольных точках 14, 21 сутки после 1, 2 и 3 химиотерапии имеют достоверное различие между группами «Панаген» и «плацебо» в общей массе данных у пациентов различных баз. В дополнение к этому практически все относительные показатели в группе «Панаген» достоверно превосходят показатели группы «плацебо». Полученные результаты свидетельствует о лейкопротекторном действии препарата Панаген.
Также достоверно отличаются значения показателей в группе «плацебо» в первой и последующих контрольных точках. Если сравнить кривые «плацебо» и «Панаген», то обращает на себя внимание достоверное падение значений показателя в большинстве изучаемых популяций клеток (лейкоциты, нейтрофилы, лимфоциты) к концу 3 химиотерапии в группе «плацебо» и сохранение значений этих показателей на исходном уровне в группе «Панаген». Эти факты свидетельствуют о протекторном действии препарата Панаген на кроветворных предшественников белого ростка кроветворения (фиг. 5).
Характерным для обеих схем химиотерапии является снижение числа нейтропений по ходу нарастающего негативного влияния на гемопоэз трех последовательных химиотерапий в группе «Панаген» и увеличение значений этого показателя в группе «плацебо».
Препарат Панаген достоверно влияет на протекцию клеток мононуклеарной фракции крови, ответственных за состояние врожденного противоракового иммунитета, от действия трех последовательных жестких химиотерапий. Было проанализировано действие препарата в направлении сохранения и стимуляции пролиферации мононуклеарных клеток врожденного противоопухолевого иммунитета. Был использован подход, при котором оценивалась неспецифическая цитотоксическая активность мононуклеарной фракции пациентов, входящих в исследование, по отношению к клеткам культуры клеток аденокарциномы человека MCF-7. Проведенные исследования свидетельствуют о протекторном и стимулирующем эффекте действия препарата на эту популяцию клеток. Цитотоксические индексы пациентов, принимавших препарат Панаген, были достоверно и существенно выше показателей в группе «плацебо» (фиг. 5).
Прием препарата Панаген в течение обеих фаз химиотерапевтической процедуры приводит к затиханию цитокинового шторма, как правило, индуцированного в организме пациента возникшим заболеванием.
Рассмотрим компенсирующее действие препарата Панаген на полную совокупность иммунных клеток организма, приводящее к успокоению процесса «штормового» синтеза и секреции ими цитокинов.
Был охарактеризован исходный уровень цитокинов и проведен анализ влияния препарата Панаген на цитокиновый профиль больных, находящихся в исследовании по поводу рака молочной железы. Известно, что спонтанное производство цитокинов клетками крови, выведенными в культуру, отражает иммунную реактивность организма in vivo, так как имитирует естественную среду. При этом также позволяет оценить вклад в цитокиновый баланс эндогенных факторов, как например, препарата Панаген. С другой стороны, стимуляция митогеном таких клеток показывает функциональное состояние иммуноцитов и их способность реагировать на новый стимул.
При клинической оценке действия препарата Панаген оказалось, что прогрессивное увеличение спонтанной продукции ФНО-α, ИЛ-1, ИЛ-IRA, ИЛ-6, ИЛ-18 и ИЛ-10 наблюдалось в только плацебо-группе. Кроме того, в группе плацебо наблюдалось увеличение производства активированных митогеном ФНО-α, ИЛ-2, ИЛ-4, ИЛ-17, ГМ-КСФ. В отличие от этого, производство ФНО-α и ИЛ-2 в группе, принимавших препарат Панаген, постепенно сокращалось и эти изменения являются статистически значимыми. Что касается физиологической значимости, то важно помнить, что увеличение системной концентрации этих двух цитокинов часто связано с начальными стадиями цитокинового шторма. Таким образом, результаты свидетельствуют о существовании цитопротекторных свойств у препарата Панаген (фиг. 6).
Двухфазная технологии применения препарата Панаген приводит к позитивным изменения в качестве жизни по шкалам (на примере рака молочной железы).
Рассмотрим влияние рассматриваемой двухфазной технологии на показатели качества жизни пациентов больных злокачественным новообразованием.
В рамках клинических испытаний препарата Панаген была проведена оценка качества жизни пациентов при помощи опросников EORTC QLQ-C30, разработанного для пациентов со злокачественными новообразованиями, и QLQ-BR23 - для пациентов с раком молочной железы. Указанные анкеты содержат по две шкалы - симптоматическую и шкалу физической активности. Опросник QLQ-C30 предусматривает также и оценку общего здоровья. Каждая шкала включает от 0 до 100 баллов. При этом для уровня функциональной активности и общего здоровья более высокие баллы свидетельствуют в сторону улучшения качества жизни, а для симптоматической шкалы - наоборот. Анкетирование проводилось до начала исследования и перед каждой химиотерапией, то есть на двадцать первые дни курсов. Применение препарата Панаген на фоне химиотерапевтического лечения рака молочной железы приводит к увеличению локальных симптоматических проявлений в очаге основного заболевания по сравнению с исходным уровнем и группой «плацебо». Сопоставляя полученный результат с данными по активации адаптивного иммунного ответа можно предположить, что локальные (в области неотрансформированного очага) симптоматические проявления связаны с активацией иммунной системы против опухолевой ткани. Такая активность должна сопровождаться усилением воспалительного процесса, связанного с лизисом раковых клеток и появлением локального болевого синдрома. На фоне приема препарата отмечается тенденция к повышению функциональной активности пациентов при проведении терапии по схеме FAC.
Список использованных источников
1. http://www.netoncology.ru
2. Smith IE, Walsh G, Jones A, Prendiville J, Johnston S, Gusterson B, Ramage F, Robertshaw H, Sacks N, Ebbs S, et al. High complete remission rates with primary neoadjuvant infusional chemotherapy for large early breast cancer. J Clin Oncol. 1995; 13(2): 424-429.
3. Fornasiero et al. 5th Int. Congress on anti-cancer chemotherapy, 1995, Paris.
4. Bernardo et al. Proc. ASCO, 14, 1995.
5. Honkoop AH, Luykx-de Bakker SA, Hoekman K, Meyer S, Meyer OW, van Groeningen CJ, van Diest PJ, Boven E, van der Wall E, Giaccone G, Wagstaff J, Pinedo HM. Prolonged neoadjuvant chemotherapy with GM-CSF in locally advanced breast cancer. Oncologist. 1999; 4(2): 106-111.
6. Darut-Jouve A, Coudert B, Jolimoy G, Belichard C, Arnoud L, Guerrin J. Neoadjuvant chemotherapy FEC-HD in locally advanced breast cancer. Bull Cancer. 1999; 86(2): 189-194.
7. Bonadonna G, Valagussa P, Moliterni A, Zambetti M, Brambilla C. Adjuvant cyclophosphamide, methotrexate, and fluorouracil in node-positive breast cancer: the results of 20 years of follow-up.N Engl J Med. 1995; 332(14): 901-906.
8. http://www.medport.info
9. (19) RU (11) 2271209 (13) CI
10. http://www.pharmaclon.ru/biblio/ros_bioter
11. http://www.ingentaconnect.com
12. WO 2009045123 Al
13. Машковский М.Д. Лекарственные средства: Пособие для врачей: в 2 т. - М.: Медицина, 1995. - 575 с.
14. ФС 42-3922-00
15. RU 2078581, C1, A61K 38/16, 10.05.1997
16. RU 2200008, C1, A61K 38/522, 10.03.2003
17. RU 2155590, C2, A61K 38/711, оп. 10.09.2000
18. RU 2136287, C1, A61K 38/70, 10.09.1999
19. RU 2161040, C1, A61K 38/78, 27.12.2000
20. RU 2137477, C1, A61K 38/70, 20.09.1999
21. RU 2313349, C2, A61K 38/711, 27.12.2007
22. RU 2322264, C1, A61K 48/00, 20.04.2004
23. Likhacheva AS, Nikolin VP, Popova NA, Dubatolova TD, Strunkin DN, Rogachev VA, Sebeleva ТЕ, Erofeev IS, Bogachev SS, Yakubov LA, Shurdov MA. Integration of human DNA fragments into the cell genomes of certain tissues from adult mice treated with cytostatic cyclophosphamide in combination with human DNA. Gene Ther Mol Biol. 2007; 11: 185-202.
24. Likhacheva AS, Nikolin VP, Popova NA, Rogachev VA, Prokhorovich MA, Sebeleva ТЕ, Bogachev SS, Shurdov MA. Exogenous DNA can be captured by stem cells and be involved in their rescue from death after lethal-dose y-radiation. Gene Ther Mol Biol. 2007; 11: 305-314.
25. RU 2429019, C2, A61K 48/00, 20.09.2011
26. RU 2234323, C1, A61K 38/713, 20.08.2004
27. RU 2490028, C1, A61K 48/00, 20.08.2013
28. Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997; 3(7): 730-737.
29. Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA. 2003; 100(7): 3983-3988.
30. Al-Hajj M, Clarke MF. Self-renewal and solid tumor stem cells. Oncogene. 2004; 23(43): 7274-7282.
31. Al-Hajj M, Becker MW, Wicha M, Weissman I, Clarke MF. Therapeutic implications of cancer stem cells. Curr Opin Genet Dev. 2004; 14(1): 43-47.
32. Поттер Е.А., Долгова Е.В., Минкевич A.M., Ефремов Я.Р., Таранов О.С., Омигов В.В., Николин В.П., Попова Н.А., Проскурина А.С., Верещагин Е.И., Козел А.В., Рогачев В.А., Петров Д.Б., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С. Терапевтические эффекты воздействия циклофосфана, препаратов двуцепочечной ДНК и их сочетания на раковые клетки асцита Кребс-2 и различные формы трансплантатов. Вавиловский журнал генетики и селекции. 2016, Т. 20, №1, стр. 96-107.
33. Поттер Е.А., Долгова Е.В., Минкевич A.M., Николин В.П., Попова Н.А., Ефремов Я.Р., Байбородин С.И., Рогачев В.А., Проскурина А.С., Козел А.В., Таранов О.С., Омигов В.В., Верещагин Е.И., Петров Д.Б., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С. Характеристика режимов терапевтического воздействия циклофосфана и препаратов двуцепочечной ДНК на опухоль Кребс-2, растущую в асцитной форме, приводящих к эрадикации первичного асцита. Вавиловский журнал генетики и селекции. 2016, Т. 20, №1, стр. 108-124.
34. Поттер Е.А., Долгова Е.В., Минкевич A.M., Николин В.П., Попова Н.А., Ефремов Я.Р., Байбородин С.И., Рогачев В.А., Проскурина А.С., Таранов О.С., Верещагин Е.И., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С. Режим однократной инъекции препарата двуцепочечной ДНК после каждой инъекции циклофосфана, приводящий к эрадикации первичного асцита Кребс-2. Вавиловский журнал генетики и селекции. 2016, Т. 20, №5, стр. 716-722.
35. Поттер Е.А., Долгова Е.В., Проскурина А.С., Ефремов Я.Р., Таранов О.С., Николин В.П., Попова Н.А., Дубатолова Т.Д., Петрова Д.Д., Верещагин Е.И., Минкевич A.M., Андрушкевич О.М., Байбородин СИ., Рогачев В.А., Останин А.А., Черных Е.Р., Колчанов Н.А., Богачев С.С. Разработка регламента терапевтического режима, основанного на синергичном действии циклофосфана и препаратов двуцепочечной ДНК, приводящего к полному вылечиванию экспериментальных животных от асцитной формы опухоли мыши Кребс-2. Вавиловский журнал генетики и селекции. 2016, Т. 20, №5, стр. 723-735.
36. Potter ЕА, Dolgova EV, Proskurina AS, Minkevich AM, Efremov YR, Taranov OS, Omigov VV, Nikolin VP, Popova NA, Bayborodin SI, Ostanin AA, Chernykh ER, Kolchanov NA, Shurdov MA, Bogachev SS. A strategy to eradicate well-developed Krebs-2 ascites in mice. Oncotarget. 2016; 7(10): 11580-94.
37. www.practica.ru/DrugBook/appendix6.htm
38. Тронов B.A., Артамонов Д.Н., Абрамов M.E., Горбачева Л.Б., Личиницер М.Р. Связь эффективности репарации ДНК, уровня экспрессии белков MLH1, MSH2 и FASR в лимфоцитах больных меланомой кожи с клиническим ответом на химиотерапию. Вопросы онкологии. 2011. Т. 5 №2. С. 165-172.
39. https://www.polismed.com/articles-analiz-krovi-rasshifrovka-obshhego-analiza-krovi
40. Dolgova EV, Efremov YR, Orishchenko KE, Andrushkevich OM, Alyamkina EA, Proskurina AS, Bayborodin SI, Nikolin VP, Popova NA, Chernykh ER, Ostanin AA, Taranov OS, Omigov VV, Minkevich AM, Rogachev VA, Bogachev SS, Shurdov MA. Delivery and processing of exogenous double-stranded DNA in mouse CD34+ hematopoietic progenitor cells and their cell cycle changes upon combined treatment with cyclophosphamide and double-stranded DNA. Gene. 2013; 528(2): 74-83.
41. Долгова E.B., Николин В.П., Попова H.A., Проскурина А.С., Орищенко К.Е., Алямкина Е.А., Ефремов Я.Р., Байбородин С.И., Черных Е.Р., Останин А.А., Богачев С.С., Гвоздева Т.С., Малкова Е.М., Таранов О.С., Рогачев В.А., Панов А.В., Загребельный С.Н., Шурдов М.А. Патологические изменения, возникающие в организме мышей, обработанных сочетанием циклофосфана и экзогенной ДНК. Вавиловский журнал генетики и селекции. 2013, Т. 17, №1, стр. 129-146.
42. www.oncology.ru/patient/medicine/cyclophosphanum-lans
43. www.oncology.ru/cathedra/lecture/lec/08.pdf
44. Proskurina AS, Gvozdeva TS, Alyamkina EA, Dolgova EV, Orishchenko KE, Nikolin VP, Popova NA, Sidorov SV, Chernykh ER, Ostanin AA, Leplina OY, Dvornichenko VV, Ponomarenko DM, Soldatova GS, Varaksin NA, Ryabicheva TG, Uchakin PN, Zagrebelniy SN, Rogachev VA, Bogachev SS, Shurdov MA. Results of multicenter double-blind placebo-controlled phase II clinical trial of Panagen preparation to evaluate its leukostimulatory activity and formation of the adaptive immune response in patients with stage II-IV breast cancer. BMC Cancer. 2015; 15(1): 122.
45. Прокопович С.К., Винницкий В.Б. Дендритные клетки и перспективы их использования в иммунотерапии злокачественных новообразований. Онкология. 2001. Т. 3, №2-3. С. 126-131.
1. Способ лечения онкологических заболеваний, основанный на применении препаратов цитостатической группы и препарата на основе экзогенной ДНК человека Панаген, отличающийся тем, что лечение проводят в две фазы, на первой из которых осуществляют цитостатическое разрушение раковой опухоли и активацию дендритных клеток мукозальной иммунной системы пациента, для чего в течение первых одних-трех суток вводят пациенту цитостатик(и) и затем со следующих суток после окончания введения цитостатика(ов) и до 12 суток от его начала пациенту вводят препарат Панаген в форме таблеток или капсул, содержащих 5 мг активной субстанции, в количестве 6 таблеток/капсул в сутки, по одной каждые 3 часа в дневное время суток, а во второй фазе, следующей за первой, в течение восьми суток повышают уровень лейкоцитов, для чего вводят препарат Панаген в количестве 3 таблетки/капсулы в сутки, по одной через каждые 6 часов в дневное время.
2. Способ лечения онкологических заболеваний по п. 1, отличающийся тем, что препарат Панаген применяют в форме перорального лекарственного средства, активная субстанция которого или входит в состав таблетки с гастроэнтерическим покрытием или расфасована в кислотоустойчивые капсулы, растворяющиеся и распадающиеся в кишечнике при нейтральной рН окружающей среды, что необходимо для защиты активной субстанции препарата от апуринизации кислой агрессивной средой желудка, в количестве 6 таблеток/капсул в сутки в течение первой фазы и 3 таблеток/капсул в течение второй фазы терапии.
https://findpatent.ru/patent/267/2675233.html
© , 2012-2022