Теломеразный белок сменил профессию
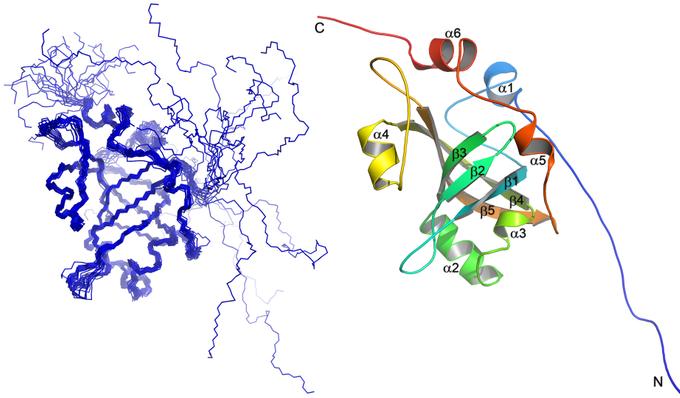
Сотрудники химического факультета МГУ, факультета фундаментальной медицины МГУ, Сколтеха и Казанского (Приволжского) федерального университета исследовали строение и функции белка Est3 теломеразы - фермента, который может стать мишенью для противораковых препаратов. Оказалось, в ходе эволюции пространственная структура белка почти сохранилась, зато изменились его функциональные свойства. Работа опубликована в журнале Scientific Reports.
Чтобы что-то менять в человеческом организме, неплохо бы понимать, как работает изменяемое. Поэтому ДНК и всё, что с ней связано, вызывает огромный интерес ученых. Отдельно пристальное внимание уделяется концевым фрагментам хромосом, в которые скручена главная молекула организма. Они организованы иначе, чем внутренние участки, и состоят из многократно повторяющихся коротких последовательностей нуклеотидов (теломеров), окруженных набором специальных белков. Такая структура необходима для защиты ДНК от случайного соединения хромосом и от других деструктивных факторов. При каждом делении клетки теломеры укорачиваются, и при достижении критически малой длины теломерных фрагментов клетка теряет жизнеспособность. Сокращение длины теломер лежит в основе механизма запрограммированного количества делений клеток эукариот, в том числе клеток человека.
В «бессмертных» клеточных линиях, к которым относятся и стволовые, и раковые клетки, длина теломер поддерживается на постоянном уровне ферментом теломеразой. Основной компонент теломеразы - субъединица с функцией обратной транскриптазы (TERT), которая синтезирует теломерную ДНК по матрице РНК, входящей в состав фермента. Теломераза дрожжей содержит вспомогательные белки Est1 и Est3, которые необходимы для ее функционирования in vivo. У этих белков есть аналоги и в теломеразе высших организмов, в том числе человека. Однако структура и функциональные свойства этих вспомогательных белков теломеразы до конца не изучены.
Учёные установили структуру белка Est3 термотолерантных дрожжей Hansenula polymorpha с помощью спектроскопии ядерного магнитного резонанса (ЯМР). Данные ЯМР позволили получить информацию не только о строении белка, но и о динамических свойствах белковой цепи в растворе. Спектроскопия ЯМР была применена также для идентификации вероятных специфических взаимодействий Est3 с фрагментами ДНК, РНК и других белков, входящих в состав теломеразного комплекса. Методы молекулярной и клеточной биологии были использованы для установления функциональной связи белка Est3 с другими компонентами теломеразы.
«Наше исследование дополняет знания о теломеразе - важном (в том числе и потенциально фармакологически важном) ферменте клеток эукариот, поддерживающем целостность генома. Результаты исследования могут быть полезны и для расширения фундаментальных знаний об эволюции белковых систем», - комментирует один из авторов исследования, доктор химических наук, ведущий научный сотрудник факультета фундаментальной медицины МГУ Владимир Польшаков.
Особенности структуры Est3 свидетельствуют о том, что в ходе эволюции функциональные свойства белка существенно изменялись при относительном постоянстве его структуры. Так, дрожжевые белки Est3 и один из доменов белка TPP1 человека, связывающегося с теломерами, имеют схожую третичную структуру, но функциональные свойства Est3 и TPP1 различны. Дрожжевой белок Est3 не обязателен для осуществления синтеза цепи ДНК в минимальной искусственной системе in vitro, однако он, наряду с Est1, необходим для формирования стабильного и функционально активного теломеразного комплекса in vivo (в клетке). Фермент теломераза, обеспечивающая «бессмертие» опухолевым клеткам, представляет значительный интерес для ученых в качестве потенциальной мишени в терапии рака. Лекарства, подавляющие активность теломеразы, могут останавливать развитие онкологического заболевания. Для рационального дизайна эффективных ингибиторов теломеразы ученым необходимо в деталях знать структуру и свойства этого сложного рибонуклеопротеинового комплекса.
«Чем лучше мы понимаем механизм функционирования фермента теломеразы и чем больше структурных аспектов нам становится известно, тем ближе мы подходим к возможности использовать эту информацию для рационального поиска новых противоопухолевых препаратов», - заключают авторы.