Рецепторы митофагии «съешь меня»
Для выживания клеток в условиях стресса ключевую роль играют механизмы избирательного удаления поврежденных и/или дисфункциональных компонентов. Они представляют собой «самопереваривание», или макроаутофагию (далее аутофагию) клетки, технически заключающуюся в секвестрации цитоплазматического «мусора» в аутофагосомы, которые сливаются с лизосомами для дальнейшей деградации «груза» фагосом. Для осуществления селективной аутофагии необходимы специфические рецепторы, которые распознают поврежденные органеллы.
Секвестосома-1 (p62) - наиболее изученный рецептор аутофагии, участвует в клиренсе многих типов цитоплазматических грузов (которые отмечены белком убиквитином для расщепления в протеасомах, то есть уже подвергнутые убиквитинированию), в том числе, склонных к агрегатам белков, митохондрий, бактерий. Рецепторы аутофагии содержат легкую цепь 3 (LC3) - интерактивную область (LIR), опосредующую их взаимодействие с белками семейства LC3 и/или GABA типа A (GABA). Для селективной аутофагии могут также потребоваться адапторные белки аутофагии, которые обладают LIR, но «выживают» после аутофагии таргетной молекулы [1].
Ликвидация митохондриального мусора (митофагия) важна для клеточного гомеостаза, особенно в постмитотических и медленно пролиферирующих клетках, таких как нейроны и кардиомиоциты. Поврежденные митохондрии не могут обеспечить эффективный синтез энергии, адекватный уровень концентрации внутриклеточного кальция, также нарушаются различные этапы метаболизма железа, жирнокислого окисления и биосинтеза аминокислот, и, как порочный круг, нарушаются механизмы апоптоза.
Ключевые инициирующие (драйверные) мутации в двух белках, вовлеченных в митофагию (E3 убиквитинлигаза PARKIN и PTEN-индуцированная киназа 1 - PINK1), связаны с болезнью Паркинсона. PINK1 стабилизируется на наружной митохондриальной мембране после утраты ею потенциала, где он фосфорилирует убиквитин и PARKIN, что приводит к активации PARKIN и дальнейшему K63-связанному полиубиквитинированию митохондриального субстрата. За этим следует рекрутирование рецепторов аутофагии, включая оптинейрин (OPTN) и белок ядерной точки 52 (NDP52), также называемый CALCOCO2.
В недавнем исследовании изучена роль NIPSNAP1 и NIPSNAP2 в процессе митофагии. Эти гены кодируют белки семейства NipSnap, участвующие в везикулярном транспорте (гены, кодирующие белки семейства NipSnap, участвующие в везикулярном транспорте). NIPSNAP1 - белок, подобный 4-нитрофосфатазному домену и не нейрональному белку SNAP-25 (25 кДа-белок, ассоциированный с синаптосомами), гомолог 1; NIPSNAP2 - соответствующий гомолог 2. Они рассматриваются как «партнеры» по связыванию p62 и ALFY, участвующих в селективной аутофагии. Это тканеспецифичные белки: NIPSNAP1 почти исключительно экспрессируется в мозге, почках и печени, тогда как NIPSNAP2, главным образом, в сердце, в меньшем количестве - в мозге, почках, печени, мышцах и бурой жировой ткани [2, 3].
NIPSNAP1 и NIPSNAP2 преимущественно обнаруживаются в митохондриальном матриксе, также на наружной митохондриальной мембране при ее деполяризации для рекрутирования рецепторов аутофагии и действуют как сигналы «съешь меня» для запуска PARKIN-зависимой митофагии (рис.1).
Оба белка взаимодействуют с NDP52, p62, NBR1, TAX1BP1 и адаптером аутофагии ALFY. ALFY связывается с p62 и способствует привлечению фагофора для осуществления селективной аутофагии путем связывания с PtdIns3P и GABARAP [4].
Удаление NIPSNAP1 у рыбок данио вызывает паркинсонизм.
Болезнь Паркинсона характеризуется гибелью дофамин-эргических нейронов в черной субстанции, что связано с дисфункцией митохондрий. Экспрессия NIPSNAP1 была наиболее значительно угнетена при исследовании полногеномного секвенирования образцов ткани пациентов с болезнью Паркинсона, по сравнению с контролем. NIPSNAP1 также демонстрирует снижение уровня экспрессии в нервных клетках SH-SY5Y, подвергнутых воздействию 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP), которое приводит к дегенерации дофамин-эргических нейронов.
У рыбок данио со сниженным NIPSNAP1, снижается митофагия в головном мозге. Из-за их постмитотического состояния и метаболической инертности нейроны особенно уязвимы для митохондриальной дисфункции.
Обнаружено, что у рыбок данио с отсутствующим функциональным NIPSNAP1 наблюдается паркинсонизм, в том числе снижение Th1-позитивных дофаминэргических нейронов и дисфункциональная нейрональная двигательная активность, устраняющаяся экзогенным L-DOPA. Данные изменения подтверждены на моделях ортологов человека и мыши [5].
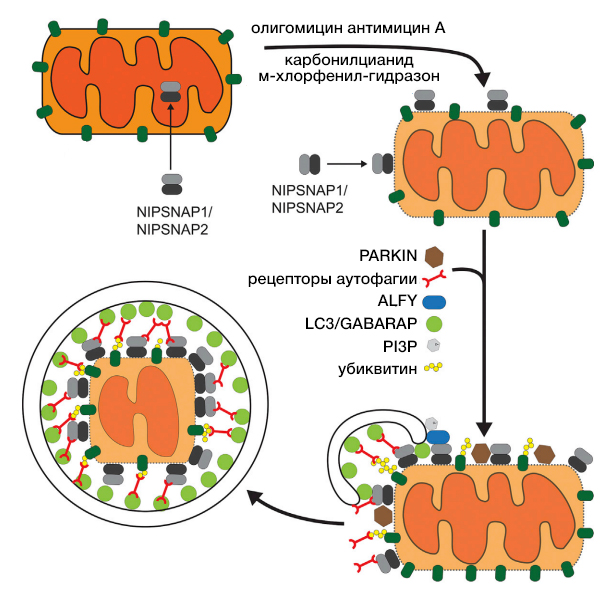
Рисунок 1 / NIPSNAP1, NIPSNAP2 - опосредованная митофагия.
Белки NIPSNAP1 и NIPSNAP2 накапливаются на наружной мембране при митохондриальной деполяризации. Там они рекрутируют белки, участвующие в селективной аутофагии, включая рецепторы аутофагии и белки ATG8, посылающие сигналы «съешь меня». Олигомицин, антимицин A, карбонилцианид М-хлорфенил-гидразон, выполняющие функции протонофор и ингибирующие функции митохондрий, за счет нарушения протонного градиента на внутренней митохондриальной мембране [5].
Источники:
1. Chen W.W., Freinkmaт E., Wang T., Birsoy K., and Sabatini D.M. (2016). Absolute quantification of matrix metabolites reveals the dynamics of mitochondrial metabolism. Cell 166, 1324-1337.e11.
2. Duan L., Hope J., Ong Q. et al. (2017). Understanding CRY2 interactions for optical control of intracellular signaling. Nat. Commun. 8, 547.
3. Gusdon A.M., Chu C.T. To eat or not to eat: neuronal metabolism, mitophagy, and Parkinson's disease. Antioxid Redox Signal. 2011 May 15;14(10):1979-87.
4. Hattori N., Saiki S., Imai Y. Regulation by mitophagy. Int J Biochem Cell Biol. 2014 Aug;53:147-50.
5. Princely A. Y., Pankiv S., Mathai B.J. et al. NIPSNAP1 and NIPSNAP2 Act as "Eat Me" Signals for Mitophagy. Dev Cell. 2019 May 20;49(4):509-525.e12.