Как создать микрофлору долгожителя
Последнее десятилетие , в области изучения микрофлоры человека, открыло во всем многообразии удивительный и густонаселенный мир микроорганизмов. Сегодня ученые считают устаревшим термин «микрофлора», предлагая более широкое понятие под названием «микробиом», или «микробиота». Микрофлора долгожителя формируется при богатом потреблении овощей, бобовых, капусты брокколи и других крестоцветных, круп, зелени, кефира. Следующая статья написана Евгенией Малышевой и незначительно скорректирована мною. Благодарю Женю за любезно предоставленную статью. Блог Евгении Малышевой - koto-mafia.livejournal.com
Когда еда и диетическое волокно попадают в кишечник (из овощей или бобовых), в результате метаболизма бактерий активируется Gpr41, который уменьшает кровяное давление на величину от 3,98 до 6.12 мм рт. ст.
То, что в почках находятся обонятельные рецепторы, стало сюрпризом даже для ученой, которая сделала это открытие - Дженнифер Плужник. Принимая во внимание их основной функционал - выделительную и осморегулирующую функцию, трудно было понять для чего нужен белок, необходимость присутствия которого, к примеру, в слизистой носа не вызывает вопросов. Тем не менее, когда она углубилась в изучение функций обонятельных рецепторов, то пришла к выводу: почки получают сообщения от бактерий, которые живут в кишечнике и находятся с нами в симбиозе. Ученые обнаружили механизм влияния микробиоты кишечника на кровяное давление.
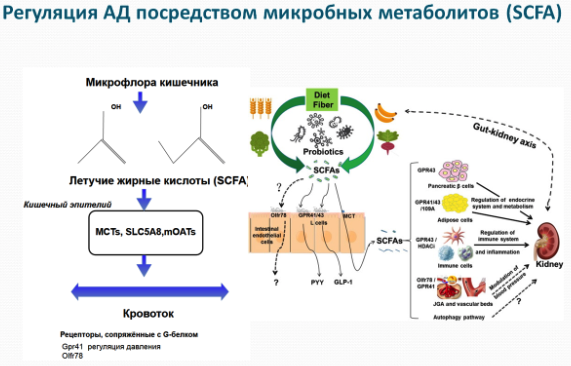 НА рисунке слева SCFA - короткоцепочечные жирные кислоты.
НА рисунке слева SCFA - короткоцепочечные жирные кислоты.
С помощью обонятельных рецепторов почки способны поддерживать прямую молекулярную связь с бактериями и, таким образом, регулировать кровяное давление. Обонятельный рецептор 51E2 (также известный как Olfr78 у мышей, и OR51E2 у человека) был мало исследован, ранее он был найден в сенсорных тканях носа. Но не было определено, на какой конкретный запах и вещество он реагирует. Плужник начала проверять все возможные сочетания химических веществ, и в конечном итоге список возможных кандидатов сузился до ацетата и пропионата. Эти молекулы короткоцепочечных жирных кислот синтезируются в процессе ферментативного распада длинных цепей углеводов - того, что диетологи называют диетическим волокном.
Многие фрукты, овощи и бобовые связаны с увеличением короткоцепочечных жирных кислот (КЖК) в питании за счёт того, что клетчатка из них является пищей для бактерий, синтезирующих КЖК.
Люди, мыши, крысы и другие животные не могут переваривать волокно. Но бактерии, которые живут в их кишках, могут. В результате более 99 процентов ацетата и пропионата, которые попадают в кровоток, являются продуктами метаболизма бактерий. Поэтому бактерии являются единственным значимым источником того, что активирует Olfr78, что, как показали дальнейшие эксперименты, связано с регуляцией артериального давления. Организм может контролировать артериальное давление с помощью гормона - ренина, который сужает кровеносные сосуды, когда необходимо повысить давление. Olfr78, как обнаружили Плужник и ее коллеги, помогает управлять синтезом ренина.
Изучая Olfr78, ученые нашли еще один рецептор, сопряженные с G-белком, под названием Gpr41, который также получает сигналы от микробиома кишечника. Gpr41 был обнаружен на внутренних стенках кровеносных сосудов. Как и Olfr78, Gpr41 также реагирует на ацетат, однако более чувствителен к пропионату, но этот рецептор снижает кровяное давление, а не повышает его. Более того, Gpr41 начинает реагировать на низкие уровни ацетата и пропионата, тогда как Olfr78 срабатывает только при высоких уровнях. Взаимодействие рецепторов и микробиома можно описать следующим образом: когда еда и диетическое волокно попадают в кишечник, в процессе метаболизма бактерий в нем образуются короткоцепочечные жирные кислоты. Это активирует Gpr41, который уменьшает кровяное давление, поскольку короткоцепочечные жирные кислоты попадают в кровоток. Чтобы давление не упало до очень низких значений, когда концентрация короткоцепочечных жирных кислот достигает пика, включается Olfr78, заставляя кровеносные сосуды сжиматься через выработку ренина.
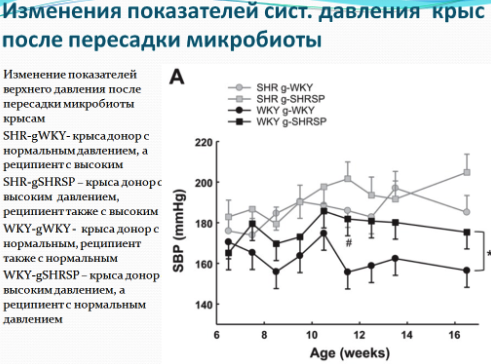
Понимание того, как симбиотические бактерии влияют на кровяное давление, открывает новые горизонты в терапии, заключающейся в модуляции микробиоты.
Возможно, фекальные трансплантаты будут одним из рабочих решений. По крайней мере, такие выводы можно сделать из недавнего исследования, где группе крыс с нормальным артериальным давлением пересаживали микробиоту крыс гиперстеников (с повышенным артериальным давлением) и наоборот. У крыс реципиентов с нормотензией, получивших трансплантанты от доноров с высоким давлением, давление было выше, чем у крыс той же группы, которым пересадили микробиоту от крыс с нормальным давлением. Не смотря на то, что давление у крыс реципиентов повысилось, оно было ниже, чем у доноров гиперстеников, что показывает, что дисбиоз кишечника является не единственным механизмом повышения давления. Поэтому пересадка крысам гипертоникам микробиоты здоровых крыс несколько снизила давление у этих крыс, но эффект был статистически незначимым. Однако на то, что микрофлора здоровых крыс не смогла снизить давление, могла также повлиять успешность пересадки микробиоты: многомерное шкалирование показало, что пересадка крысам с нормальным артериальным давлением микробиоты гипертоников (с повышенным артериальным давлением) завершилась успешно - микробиота крыс с нормотензией (с нормальным давлением) стала похожей на микробиоту доноров гипертоников, в то время как пересадка в обратную сторону от здоровых крыс к гипертоникам оказалась менее успешной.
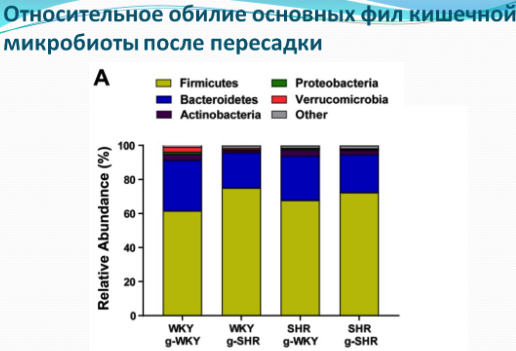
Таким образом, доказано, что состав микробиоты влияет на показатели давления, и требуются дальнейшие исследования по изучению возможностей успешной модуляции микробиоты возможно через прием новых форм пре и пробиотиков. На данный момент терапия с помощью пробиотиков может лишь немного снижать показатели артериального давления. Метаанализ 14 рандомизированных, плацебо-контролируемых клинических испытаний, включающих в общей сложности 702 участников показал скромное, хотя и статистически значимое, снижение систолического (-3мм рт. ст.) и диастолического (-1мм рт. ст.) давления. Эффект был более выраженным у пациентов с гипертонией (-3,98 мм рт. ст систолическое АД), чем у нормотензивных участников (-2,09мм рт.ст.),и был более выражен в шести японских исследованиях(-6,12 мм рт. ст.), чем в восьми европейских.
Отдельный метаанализ оценивал влияние пробиотиков на уровень артериального давления в девяти рандомизированных, контролируемых испытаниях с участием 543 участников. В целом, анализ показал статистически значимое снижение систолического артериального давления (-3,56 мм рт.ст.; 95% ДИ -6,46 до -0,66) и диастолического артериального давления (-2,38 мм рт.ст.; 95% ДИ-3,84 до -0,93), но индивидуальный эффект сильно отличался от исследования к исследованию. Йогурт был основным источником пробиотиков в этих исследованиях (4 из 9), но остальные исследования включали также другие кисломолочные продукты (сыр и капсулы), содержащие специфические бактериальные штаммы.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC5474689
- www.ncbi.nlm.nih.gov/pubmed/28011881
- www.ncbi.nlm.nih.gov/pmc/articles/PMC5243208
Короткоцепочечные жирные кислоты, синтезируемые микрофлорой кишечника, при употреблении бобовых и овощей, снижают разрушение костей.
Известно, что короткоцепочечные жирные кислоты обладают противовоспалительным эффектом, и диета богатая клетчаткой снижает потерю костной массы у пациентов с ревматоидным артритом. Результаты этих исследований сподвигли ученых на дальнейшее изучение воздействия короткоцепочечных жирных кислот на потерю костной массы после менопаузы или во время воспалительных процессов. Ученые проводили на крысах несколько интервенций: диету обогащали клетчаткой, давали крысам короткоцепочечные жирные кислоты напрямую или модулировали микробиоту. После приема короткоцепочечных жирных кислот и диеты богатой клетчаткой у крыс росло содержание короткоцепочечных жирных кислот в сыворотке крови и костном мозге и снижалась активность остеокластов (клеток, разрушающих костную ткань), а следовательно снижалось разрушение кости. Пропионовая и масляная короткоцепочечные жирные кислоты (пропионат и бутират) вызывали метаболическое перепрограммирование остеокластов, что приводило к усилению гликолиза за счет окислительного фосфорилирования, тем самым снижался уровень специальных белков, таких как TRAF6 и NFATc1, необходимых для дифференцировки остеокластов. В целом, эти данные характеризуют короткоцепочечные жирные кислоты как мощные регуляторы метаболизма остеокластов и костного гомеостаза.
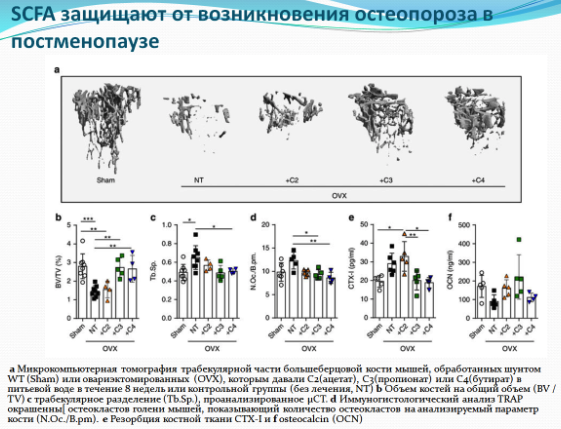
Еще более важно то, что в случае потери костной массы при воспалении, может быть особенно полезной комбинация противовоспалительных иммуномодулирующих свойств короткоцепочечных жирных кислот вместе с прямым ингибированием активности остеокластов. В этом контексте можно объяснить преимущества применения диеты средиземноморского типа, богатой клетчаткой, которая повышает уровень короткоцепочечных жирных кислот, для больных ревматоидным артритом.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/11252685
- www.nature.com/articles/s41467-017-02490-4
Бутират, который синтезируется микрофлорой при употреблении овощей и бобовых, может снижать риск рака толстой кишки, опухоли мозга, способен влиять на продолжительность жизни животных, изменяя работу генов.
Давайте рассмотрим воздействие короткоцепочечных жирных кислот на увеличение продолжительности жизни. Жизнь продлевала одна из продуцируемых в кишечнике летучих кислот (короткоцепочечная жирная кислота) - масляная кислота или бутират. В серии опытов она увеличивала продолжительность жизни модельных животных: например, у плодовых мух Drosophila melanogaster увеличилась средняя и максимальная продолжительность жизни на 25.8 и 11.5 соответственно. Эффект был дозозависимым, и дозы выше 100 mM даже снижали продолжительность жизни, в то время как оптимальный эффект был достигнут при дозировке (10-40mM). Эффект зависел также от стадии, на которой насекомому начинали давать натриевую соль масляной кислоты (SB): увеличение продолжительности жизни во всех исследованиях было при приеме натриевой соли масляной кислоты на стадии личинки, в то время как прием на стадии взрослого насекомого или прием в течение всех стадий мог дать различный результат, как положительный, так и отрицательный или нулевой. Этот факт может означать, что воздействие натриевой соли масляной кислоты происходит через эпигенетические механизмы продления жизни, базирующиеся на модификации гистонов, и может быть связан с тем, что на разных стадиях жизни насекомого (стареющих животных) паттерны экспрессии генов отличаются. Изменения в ацетилировании гистонов и экспрессия генов белков шаперонов способствовала продлению жизни D. melanogaster. Кроме того натриевая соль масляной кислоты воздействовала и через другие механизмы. Так в исследовании натриевая соль масляной кислоты снижала раннюю смертность мух с, индуцированной пестицидами, болезнью Паркинсона. Натриевой соли масляной кислоты-опосредованно индуцированная выживаемость мух с ротенон-индуцированной болезнью Паркинсона проявлялась повышенными уровнями дофамина в мозге мухи.
Кроме стадии, с которой начинался прием натриевой соли масляной кислоты (SB), на усиление продлевающих жизнь эффектов SB влияло также время жизни насекомого: коротко живущие виды мух были более чувствительны к терапии SB, чем долгоживущие виды. Кроме того гендер насекомого также имел значение для увеличения продолжительности жизни. Sodium Butyrate увеличивал среднюю продолжительность жизни червей C.elegans на 20% и усиливал их термостойкость, также в эксперименте на C.elegans SB увеличивала продолжительность жизни через экспрессию генов SATB-1 и CBP. Экспрессия этих же генов у мышей, доказано, снижается с возрастом и с появлением диабета. Линия мышей с усиленной активностью этих генов жила дольше, чем линия, где активность была снижена. Что касается мышей, то SB увеличивала продолжительность жизни мышей с амиотрофическим склерозом и снижала мускульную атрофию у пожилых мышей.
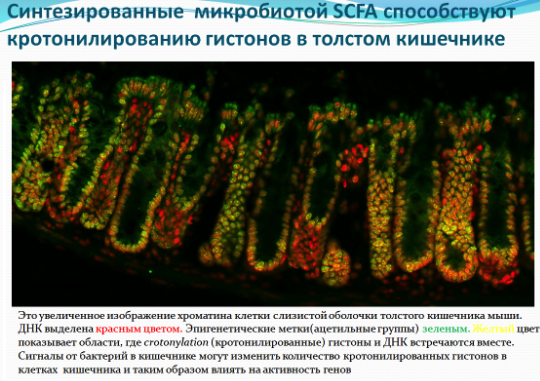
Связь между короткоцепочечной жирной кислотой (бутиратом), как ингибитором HDAC и меньшим риском возникновения рака прямой кишки, недавно открыли ученые. Команда, возглавляемая доктором Патриком Варга-Вайшем (Patrick Varga-Weisz), доказала, что метаболиты, производимые бактериями в кишечнике, могут изменять активность генов в клетках слизистой кишечника. И, в конечном итоге, влияют на поведение этих клеток. Команда ученых показала, что короткоцепочечные жирные кислоты увеличивают количество кротонилированных гистонов, отключая белок под названием HDAC2. Ученые считают, что изменение количества подобных «меченых» гистонов может изменить активность генов путем их включения или выключения. Это новое исследование показало, что бутират увеличивает количество эпигенетических меток в виде остатков кислот на наших генах. Речь идёт о недавно открытом процессе кротонилирования (crotonylation), еще одной формы генетической манипуляции, отличающейся от широко известного метилирования. Оба процесса изменяют экспрессию генов, при этом сам генетический код не изменяется. В то время как процесс метилирования включает в себя добавление метильной группы (СН3) к нуклеотидному основанию - обычно цитозин (С), но иногда аденозин (А) - ацетилирование и кротонилирование связывает ацильную группу (ацетильную или кротонильную) с белками упаковщиками ДНК - гистонами. Гистоны все время взаимодействуют с ДНК, но они могут упаковать ее очень плотно, что ведет к уменьшению промежутка между нуклеосомой и намотанной на неё ДНК, так что с ней нельзя будет работать, а могут, наоборот оставить доступ, менее крепко связываясь с ДНК, так что с нее смогут считывать генетическую информацию специальные молекулярные машины.
Насколько сильно гистоны упакуют ДНК, зависит от того, какие на них будут химические модификации. У каждой клетки есть целый набор ферментов, которые вешают или снимают с гистонов те или иные химические метки, заставляя эти белки упаковывать ДНК то плотнее, то слабее. К таким ферментам относятся и вышеупомянутые гистоновые деацетилазы (HDAC) - они занимаются тем, что снимают с гистонов химические метки в виде остатков кислот. Но и их активность тоже зависит от разных факторов, в том числе и от разнообразных молекул, которые могут эти ферменты выключать. В итоге, с гистонов никто не снимает метки, которые навесили на них другие ферменты. Такие меченые (кротонилированные) гистоны связываются с ДНК иначе, чем «чистые» гистоны, и особым образом настраивают активность генов.
Мышам в эксперименте давали антибиотики, чтобы уничтожить большую часть их микрофлоры. В результате синтез короткоцепочечных жирных кислот снизился, а эпителиальные клетки кишечника мышей содержали большее количество белка HDAC2, чем обычно. В ходе предыдущих исследований учёные выяснили, что увеличение экспрессии HDAC2 в толстой кишке связано с возникновением рака кишечника. Исследователи полагают, что регулирование процесса кротонилирования в геноме кишечных клеток имеет большое значение для предотвращения развития этого вида рака. Кротонилирование активируется посредством ингибирования экспрессии белка HDAC. Ученые также обнаружили высокие уровни кротонилирования гистонов в головном мозге. Поскольку короткоцепочечные жирные кислоты могут преодолевать гематоэнцефалический барьер, вероятно, они могут влиять на модификации гистонов и в мозге, и это также предстоит выяснить ученым.
Ссылки на исследования:
- https://link.springer.com/article/10.1134%2FS2079057013010153
- www.ncbi.nlm.nih.gov/pubmed/23623990
- https://link.springer.com/chapter/10.1007%2F978-3-319-18326-8_11
- www.nature.com/articles/s41467-017-02651-5
Добавление колановой кислоты в среду культивирования человеческих клеток, а также в пищу червей или лабораторных плодовых мушек увеличивало продолжительность жизни животных и, соответственно, человеческих клеток.
Исследователи Бэйлорского медицинского колледжа и университета Техаса под руководством адъюнкт-профессора Мэна Вана (Meng Wang), нашли бактериальные гены и синтезируемые бактериями соединения, способные увеличивать продолжительность жизни и замедлить прогрессию опухолей, а также уменьшать ассоциированного с болезнью Альцгеймера накопление бета-амилоида у нематод Caenorhabditis elegans. По техническим причинам этот вопрос очень сложно изучать на млекопитающих, поэтому исследователи использовали в качестве модели круглых червей C.elegans, представляющих собой прозрачные простые организмы размером с булавочную головку, геном которых во многом схож с геномом человека. В течение 2-3-недельного жизненного цикла эти черви питаются бактериями, вырастают во взрослую особь, размножаются и прогрессивно стареют, утрачивая силу и здоровье, и умирают. Множество лабораторий используют C.elegans в качестве модели для изучения фундаментальных биологических процессов.
До сих пор никто не проводил систематический, полногеномный поиск геномных ассоциаций у бактерий, которые бы оказывали геропротекторное воздействие на C. elegans. Для изучения влияния бактериальных генов по отдельности на продолжительность жизни C.elegans ученые использовали полную библиотеку делеций (удалений) фрагментов генов кишечной палочки Escherichia coli - коллекцию штаммов, каждый из которых является носителем делеции одного из 3983 генов.
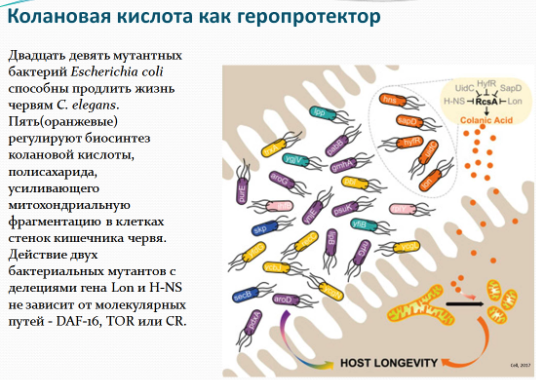
Они скармливали червям бактерии мутантных штаммов и после этого оценивали их продолжительность жизни. В результате оказалось, что для почти 4 000 протестированных бактериальных генов делеции 29 бактерий мутантов продлевали жизнь червям более чем на 10%. Мутант-чемпион, кодирующий транскрипционный регулятор, смог увеличить продолжительность жизни червей на 40%. Многие из мутантов не продлевали жизнь червей, которые уже имели мутации в генах, ранее известных модуляторов продолжительности жизни, таких как daf-16, rsks-1, raga-1, rict-1 или мутацию, которая имитирует ограничение калорийности. Также ученые проверяли влияние бактериальных мутаций на такие возраст-зависимые заболевания, как рак и болезнь Альцгеймера. Исследователи протестировали мутантные бактерии на C. elegans, подверженных развитию опухолей, и в Aβ-экспрессирующих трансгенных червях. Последние были разработаны Крисом Линком в Университете Колорадо в Боулдере; они экспрессируют Aβ42 под контролем мышечно-специфического не-54 промотора / энхансера. Четырнадцать бактериальных мутантов продлевали жизнь этих трансгенных червей на 10-40%. При этом 12 из них отодвигали развивающийся у C.elegans возрастной паралич. Интересно, что 13 из 14 мутантов, продлевающих жизнь, также продлевали жизнь нематод, подверженных развитию опухоли.
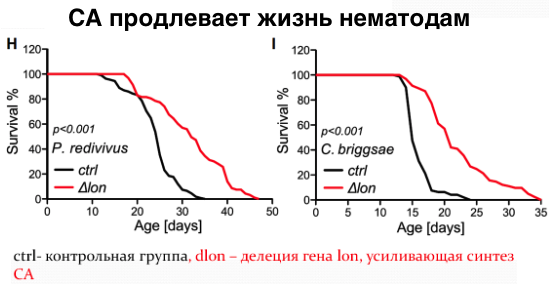
Дальнейшие эксперименты показали, что употребление в пищу определенных мутантных штаммов кишечной палочки увеличивало продолжительность жизни нематод посредством воздействия на ряд неизученных ранее процессов, ассоциированных со старением этих организмов. Эти мутанты способствовали долголетию за счет повышенной продукции колановой кислоты - полисахарида, составляющего защитную капсулу бактерий. Добавление очищенной колановой кислоты в пищу червей также увеличивало продолжительность их жизни, хотя и в меньшей степени, чем при использовании мутантных бактерий. Аналогичное влияние колановая кислота оказывала при добавлении в корм лабораторных плодовых мушек, а также в среду культивирования человеческих клеток.
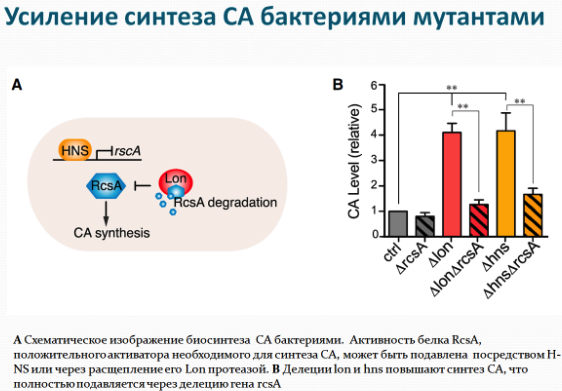
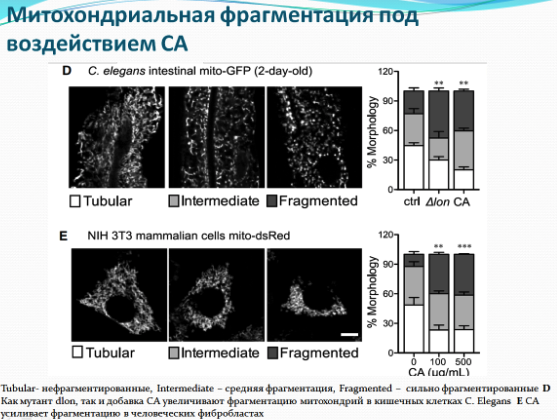
Исследователи провели поиск мутаций, при которых колановая кислота не оказывала бы положительного влияния на червей. Действительно две мутации связанные с повреждением электрон-транспортной цепи митохондрий нивелируют эффекты колановой кислоты. Интересен также установленный ими факт, что колановая кислота регулирует динамику процессов слияния и деления митохондрий - внутриклеточных структур, являющихся энергетическими центрами клетки. Ван и ее коллеги заметили, что митохондрии в кишечных клетках червей, питающихся колановой кислотой, были более фрагментированными, чем у необработанных нематод. Это СА-индуцированное расщепление митохондрий также происходило в клеточной линии фибробластов млекопитающих. Несмотря на то, что митохондриальная фрагментация в стареющих мышцах стенок тела червя считается признаком возрастной атрофии, исследователи полагают, что фрагментация в клетках кишечника и фибробластах, вызванная колановой кислотой, может отражать усиление механизма «контроля качества» здоровых клеток (митофагии), который избавляет клетки от поврежденных или дисфункциональных митохондрий. Как известно белки DRP-1 (диамин-подобный белок 1) необходимы для деления митохондрий и связаны с увеличением продолжительности жизни. Исследователи добавили колановую кислоту к drp-1 мутантным червям, и, как и ожидалось, колановая кислота не смогла увеличить продолжительность жизни.
Исследователи предполагают, что в будущем полученные ими данные лягут в основу разработки препаратов для замедления процессов старения на основе бактерий или их компонентов. Эти наблюдения также могут помочь разобраться во взаимодействиях между микроорганизмами и их хозяевами. Существует гипотеза, согласно которой митохондрии появились в результате эволюции бактерий, миллионы лет назад проникших внутрь примитивных клеток. Полученные авторами данные свидетельствуют о том, что бактерии и по сей день оказывают влияние на взаимодействие митохондрий внутри клеток живых организмов. Судя по всему, этот тип взаимодействия очень важен, и его детальное понимание позволит разобраться в глубинных взаимоотношениях между бактериями и организмами, с которыми они сосуществуют. Перед исследователями стоят еще несколько нерешенных проблем: предстоит выяснить механизм синтеза колановой кислоты in vivo, пока ученым известно, что клеточные культуры синтезируют колановую кислоту в ответ на стресс во время формирования биофильма. Также не решена проблема почти в двое меньшей эффективности чистой колановой кислоты по сравнению с кислотой, синтезированной бактериями мутантами.
Окажет ли эта работа влияние на лечение нейродегенеративных заболеваний? Крис Линк отметил, что взаимодействие митохондрий и колановой кислоты соответствует его неопубликованному наблюдению, что смещение баланса митохондриального деления и слияния в сторону деления делало Aβ-экспрессирующих трансгенных червей более мобильными. У червей с нокаутом гена, кодирующего белок DRP-1, уменьшалось деление митохондрий, что и ожидалось, но также усиливался паралич. Тогда как выключение EAT-3, гена, необходимого для митохондриального слияния, делало червей более активными. Линк добавил, что многие митохондрии в мышечных клетках были деформированы и деполяризованы, и он подозревает, что амилоид может вызывать повреждения в них. Если это так, то увеличение оборота органелл может быть полезным. Неясно только, как этот сценарий развернется в мозге.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC5587646
- www.alzforum.org/news/research-news/longevity-through-gut-bacteria-it-works-worms
Сульфорафан из капусты брокколи и других крестоцветных овощей + модифицированные бактерии E. coli возможно помогут в будущем избавить человечество от рака толстой кишки
Если воздействие через метаболиты C. Sporonges на здоровье организма пока только в планах ученых, то применение коктейля из генномодифицированных бактерий Escherichia coli(грамотрицательные бактерии, входящих в состав нормальной микрофлоры желудочно-кишечного тракта человека) и сульфорафана уже прошло удачное тестирование на модельных животных. Сульфорафан из капусты брокколи - это вещество широко известное своими антиканцерогенными свойствами, однако проблемой химиопрофилактики с помощью сульфорафана была его низкая биодоступность. Сульфорафан синтезируется в крестоцветных из содержащихся в них глюкозинолатов под воздействием фермента мирозиназы, когда клетки растений разрушаются (например, при жевании капусты брокколи). Однако мирозиназа чувствительна к температуре и в кулинарно обработанных овощах остается лишь небольшое количество этого фермента, а мирозиназы, синтезируемой человеческой микрофлорой, недостаточно для проявления антираковых свойств сульфорафана. Низкая доза этого противоопухолевого соединения может быть неэффективной в отношении раковых клеток, а высокая вызвать цитотоксичность.
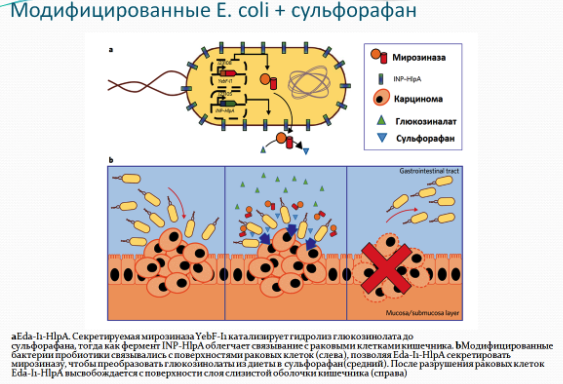
Эти данные побудили ученых из Национального университета Сингапура предположить, что антираковая эффективность диеты богатой крестоцветными возрастет, если мирозиназа будет синтезироваться в достаточном количестве, а сульфорафан прицельно попадать в раковые клетки толстого кишечника. Для этого специалисты генетически модифицировали бактерии E. Coli, чтобы те могли вступить во взаимодействие с гепарансульфат-протеогликаном - веществом, которое образуется на поверхности клеток рака толстой кишки. Фермент, продуцируемый бактериями, будет в кишечнике превращать глюкозинолат из брокколи в сульфорафан, который затем остановит рост раковых клеток и спровоцирует их самоуничтожение. Затем сконструированные бактерии отделятся от стенок кишечника и смешаются с фекалиями.
Данный механизм был дважды успешно протестирован. В первый раз были произведены испытания в пробирке, которые показали, что комбинация модифицированных бактерий и глюкозинолатов убивает свыше 95% колоректальных раковых клеток, и не оказывает влияния на клеточные линии рака груди, желудка и здоровые клетки. Эксперимент не показал значительное снижение риска опухоли у мышей, получавших модифицированные бактерии в качестве пробиотика в сочетании с диетическим глюкозинолатом из крестоцветных (капуста брокколи и др.). Специфическое распознавание бактериями поверхности клетки позволило модифицированным E.Coli прицельно связываться с раковыми клетками, тогда как секретируемая ими мирозиназа приводила к увеличению синтеза сульфорафана для его активного поглощения раковыми клетками. Это привело к более чем 75% уменьшению опухоли в колоректальной области у мышей с искусственно вызванным раком кишечника.
Стратегия использования диетических компонентов и модифицированных бактерий продемонстрировала возможность превратить обычную диету в экономически эффективную и устойчивую терапию раковых заболеваний. Следующий шаг - эксперимент с участием людей- -добровольцев. Но прежде чем перейти к нему, специалистам предстоит преодолеть еще ряд препятствий. Главное из них - риск побочных эффектов от посева модифицированных бактерий в организмы людей. В настоящее время ученые работают над созданием «системы самоуничтожения» измененных бактерий в случае их неправильного поведения.
Ссылка на исследование:
- www.nature.com/articles/s41551-017-0181-y
Пересадка донорского кала поможет в будущем создать таблетки, которые омолодят нашу микрофлору до состояния молодого человека и продлят нашу жизнь.
Признаки старения проявляются на рыбах вида Нотобранх Фурцера также как на остальных животных: они болеют раком, теряют пигментацию, у них ухудшаются двигательные и умственные способности. Исследователи из Института биологии старения им. Макса Планка в Кельне изучают влияние микробиоты кишечника на старение и продолжительность жизни. Их результаты показывают, что пожилые животные остаются активными и дольше живут, если они получают кишечные бактерии более молодых членов своего вида. Результаты показывают, что микроорганизмы в кишечнике влияют на старение организма. У рыб Нотобранх Фурцера признаки старения появляются спустя несколько месяцев их жизни, и они представляют собой идеальный модельный организм для исследования старения. Их короткий срок жизни сопоставим с червями нематодами C.elegans и фруктовыми мухами Drosophila, которые исследователи также используют в качестве модельных организмов. В отличие от двух последних рыбы являются позвоночными и, следовательно, находятся ближе к людям, чем насекомые и черви.

Микробиота кишечника Нотобранх Фурцера сходна по своему разнообразию и составу с микробиотой человека. Микроорганизмы в кишечнике влияют на абсорбцию нутриентов, обмен веществ и иммунную систему. Как и в случае с людьми, старение влияет на состав микробного сообщества. Бактериальное разнообразие обеспечивает здоровье кишечника, когда рыбы молоды. Но в старости это разнообразие уменьшается, а в микробном составе начинают преобладать организмы патогены.
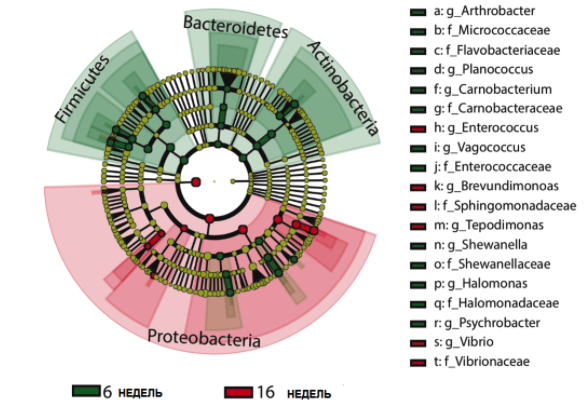
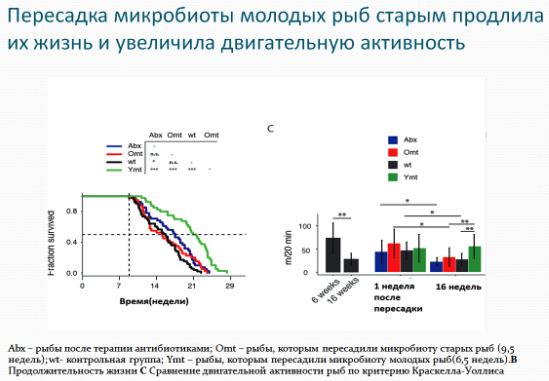
Чтобы проверить, влияют ли изменения в микробиоме на процесс старения, команда Валенцано «пересадила» кишечные микробы 6-недельных рыб рыбам в возрасте 9,5 недель. Сначала ученые обработали рыб среднего возраста антибиотиками, чтобы очистить их кишечную флору, затем поместили их в стерильный аквариум, содержащий содержимое кишечника молодых рыб, на 12 часов. Нотобранх Фурцера, как правило, не едят фекалии, но они зондируют и пробуют фекалии, чтобы понять, является ли это пищей, поглощая микробы в процессе. Пересаженные микробы успешно поселились в кишечнике рыб. Микробиота рыб пожилого возраста (16-недельных) при этом стала «молодой», как у 6 недельных рыб доноров.
Микробиомная «трансплантация» также оказала сильное воздействие на продолжительность жизни рыб: их средняя продолжительность жизни была на 41% длиннее, чем у рыб, которым пересадили микробиоту рыб среднего возраста, и на 37% длиннее, чем у рыб, которые не подвергались фекальной трансплантации (прием антибиотиков без фекальной трансплантации также продлевал срок жизни, но в меньшей степени). И в возрасте 16 недель - старость по стандартам Нотобранх Фурцера - уровень активности рыб, перенесших кишечную трансплантацию молодой микробиоты, был похож на уровень активности 6-недельных рыб. Напротив, кишечные микробы от более старых рыб не влияли на продолжительность жизни более молодых рыб, по данным ученого Валенцано и его команды.
Каким образом микробы влияют на продолжительность жизни остается неизвестным. Одна из возможностей заключается в том, что иммунная система изнашивается с возрастом, позволяя патогенным микробам более успешно конкурировать с полезными бактериями. После этого пересадка микробиоты могла бы произвести перезагрузку микробиома рыб среднего возраста. Компоненты более молодого микробиома могут также способствовать долголетию, так или иначе влияя на функционирование самой иммунной системы. Роберт Бейко, биоинформатик, изучающий микробные сообщества в Университете Далхаузи в Галифаксе, Канада, надеется получить финансирование, чтобы провести исследование влияния фекальной трансплантации на старение у мышей. Он также задается вопросом, может ли собственный микробиом человека, отобранный и сохраненный (например, замороженный) на ранней стадии жизни, увеличить продолжительность после пересадки в среднем возрасте.
Ссылка на исследование:
- www.nature.com/news/young-poo-makes-aged-fish-live-longer-1.21770
В будущем в нашей микрофлоре управляемый синтез индола будет замедлять возрастное одряхление организма и возможно продлевать жизнь.
 Согласно новому исследованию, индол, органическое химическое соединение, увеличивает здоровый срок жизни червей, мух и мышей. Исследователи под руководством Даниэля Кальмана из Университета Эмори в Атланте говорят, что это может быть применимо и к людям. Это ароматическое вещество в конечном итоге может быть использовано для отсрочки появления связанных с возрастом заболеваний. Индол - это ароматическое органическое соединение, обладающее очень неприятным запахом, и наряду со скатолом, сероводородом и меркаптанами, придает нашим фекалиям хорошо известный вонючий запах. Новое исследование показывает, что индольные соединения, продуцируемые бактериями в кишечнике, продлевают здоровое состояние разнообразных организмов. В исследовании животные, подвергшиеся воздействию этих соединений, дольше оставались здоровыми в течении жизни, чем животные, которые не подвергались воздействию этого соединения.
Согласно новому исследованию, индол, органическое химическое соединение, увеличивает здоровый срок жизни червей, мух и мышей. Исследователи под руководством Даниэля Кальмана из Университета Эмори в Атланте говорят, что это может быть применимо и к людям. Это ароматическое вещество в конечном итоге может быть использовано для отсрочки появления связанных с возрастом заболеваний. Индол - это ароматическое органическое соединение, обладающее очень неприятным запахом, и наряду со скатолом, сероводородом и меркаптанами, придает нашим фекалиям хорошо известный вонючий запах. Новое исследование показывает, что индольные соединения, продуцируемые бактериями в кишечнике, продлевают здоровое состояние разнообразных организмов. В исследовании животные, подвергшиеся воздействию этих соединений, дольше оставались здоровыми в течении жизни, чем животные, которые не подвергались воздействию этого соединения.
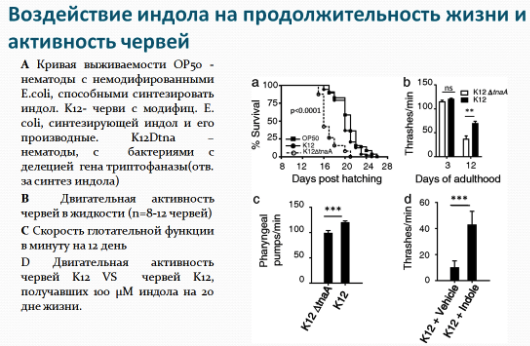
Важно отметить, что индол не продлевал общую продолжительность жизни животных - скорее, продлил продолжительность периода времени до того, как начнут появляться возрастные проблемы. 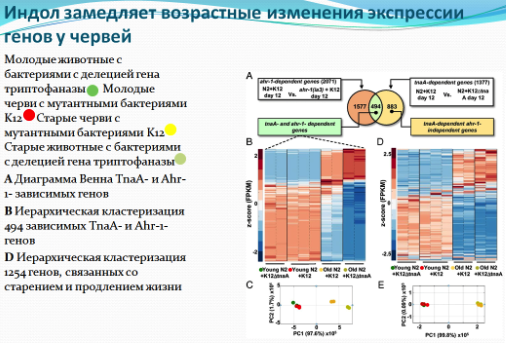 В качестве подопытных организмов биологи использовали червей нематод Caenorhabditis elegans, плодовую муху Drosophila melanogaster и грызунов.
В качестве подопытных организмов биологи использовали червей нематод Caenorhabditis elegans, плодовую муху Drosophila melanogaster и грызунов.
На животных испытали действие индола и его некоторых производных (индол-3-карбоксальдегида и гетероауксин). Эти вещества синтезировались штаммом K12 кишечной палочки (Escherichia coli), которая помещалась в кишечный тракт животных. Состояние последних сравнивали с возрастными изменениями модельных животных, внутри которых обитала E.coli, неспособная синтезировать производные индола, а также с животными, внутри которых помещались еще одни модифицированные бактерии с делецией (удалением участка) гена триптофаназы, не способные синтезировать индол. Для всех испытуемых видов синтезируемый индол увеличил несколько стандартных показателей здоровой продолжительности жизни, включая физическую активность, реакцию на стресс и репродуктивные способности. Синтез индола у стареющих червей нематод позволял им оставаться активными после 15-дней жизни. К тому же черви C. elegans становились более устойчивыми к тепловому стрессу. Кроме того индол-продуцирующие черви оставались фертильными (могли размножаться) почти 12 дней (вместо обычных 5), т.е. индол более чем в двое увеличил их репродуктивный возраст. Аналогично, у мышей индол позволял старым грызунам, которым было 28 месяцев, поддерживать юношеский здоровый уровень массы тела, подвижности и активности. Индол, как оказалось, продлевал жизнь и у молодых мышей. В мышиной модели, в которой грызуны подвергались воздействию опасных для жизни уровней излучения, мыши, продуцирующие индол, жили дольше.
Для определения механизма действия индола ученые последовательно отключали гены у червей C.elegans, отвечающие за восприимчивость к стрессу и регуляцию продолжительности жизни. Оказалось, что действие индола в мухах и червях опосредуется через арил-гидрокарбоновый рецептор (AHR), который передает сигнал от связывающихся с ним ксенобиотиков внутрь клетки. В итоге, у стареющих червей C.elegans в ответ на присутствие индола в кишечнике изменяется активность генов таким образом, что гены начинают работать как у молодых животных.
Ученым предстоит выяснить, как именно индол генерирует эти наблюдаемые преимущества для здоровья у животных. Но ведущий исследователь Даниэль Кальман с осторожным оптимизмом относится к тому, что это соединение в конечном итоге может быть использовано для отсрочки появления возрастозависимых заболеваний и у людей.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/27158906
www.sciencedaily.com/releases/2014/08/140801125050.htm
www.nature.com/articles/srep46337
www.ncbi.nlm.nih.gov/pubmed/29168502
www.ncbi.nlm.nih.gov/pmc/articles/PMC5292609
Диета, богатая продуктами из цельного зерна за счет содержания триптофана, увеличивает концентрацию индол-пропионовой кислоты и защищает людей от сахарного диабета 2-го типа, и снижает накопление бета-амилоидных бляшек (важного фактора развития болезни Альцгеймера)
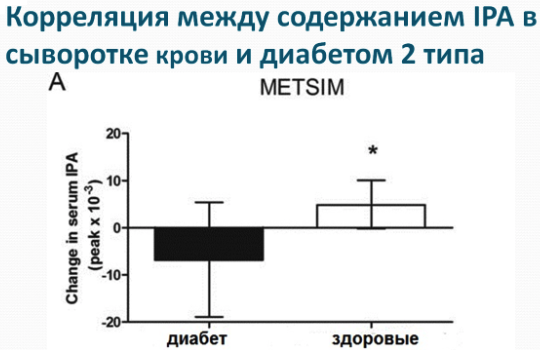
Недавнее исследование финских ученых, опубликованное в апреле 2017, показало, что высокие концентрации еще одного метаболита триптофана - индол-пропионовой (ИПК, IPA) кислоты в сыворотке крови защищают от диабета 2-го типа. Долговременное исследование пациентов с метаболическим синдромом (лишним весом и нарушенной толерантностью к глюкозе) показало, что их можно разделить на две группы: группа, в которых диабет развился в течение 5 лет и те, у которых не проявилось это заболевание в течение последующих 15 лет, включительно. Отличительным признаком второй группы является высокое содержание индол-пропионовой кислоты в сыворотке крови. Диета, богатая продуктами из цельного зерна за счет содержания триптофана, увеличивала концентрацию индол-пропионовой кислоты. Более высокая концентрация индол-пропионовой кислоты, как оказалось, способствует секреции инсулина бета-клетками поджелудочной железы, чем можно объяснить ее защитное действие. О положительном влиянии индол-пропионовой кислоты на организм известно давно. Еще в 1999 году ученые установили, что индол-пропионовая кислота может предотвращать формирование бета-амилоидных бляшек, а значит является потенциальным средством профилактики болезни Альцгеймера.
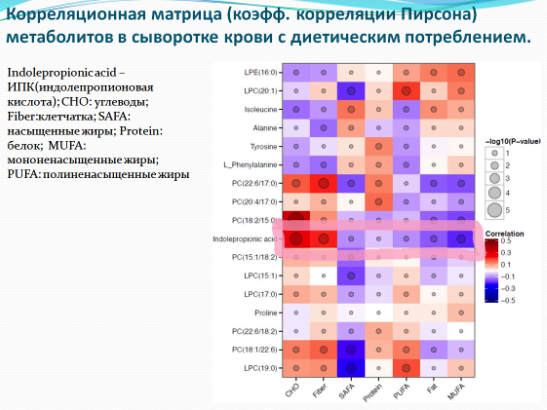
Известно, что расщепление аминокислот тирозина и фениланина проходит с участием фермента фениллактат дегидратазы (Fld). Исследователи предположили, что этот же фермент участвует в метаболизме триптофана с образованием индол-пропионовой кислоты. Для проверки, у бактерий C. Sporogenes был выключен ген fldC, кодирующий одну из субъединиц этого фермента. Концентрацию метаболитов определяли при помощи газовой хроматографии, совмещенной с масс-спектрометрией. Культура мутантных бактерий действительно перестала продуцировать индол-пропионовую кислоту. После того, как кишечник стерильных мышей заселили модифицированные и исходные бактерии, измерили концентрацию индол-пропионовой кислоты в сыворотке крови. У мышей с генномодифицированными бактериями индол-пропионовая кислота не определялась, в то время как у контрольных особей концентрация индол-пропионовой кислоты в сыворотке составила около 80 микромолей. У мышей с мутантными бактериями была выше проницаемость стенок кишечника, что является признаком таких заболеваний как болезнь Крона. Кроме того в периферической крови этих животных возросло количество как зрелых Т-клеток (хелперов и цитотоксических Т-лимфоцитов), так и нейтрофилов, и макрофагов - клеток врожденного иммунного ответа. Таким образом, через изменение микробиоты, активировалась иммунная система хозяина, и происходили изменения в гуморальном иммунитете.
Исследователи надеются, что им удастся разработать новую парадигму для лечения некоторых заболеваний: вместо того, чтобы давать соединение, такое как индол-пропионовая кислота, врачи смогут увеличить популяцию бактерий, продуцирующих в частности индол-пропионовую кислоту. Таким образом смогут повысить синтез определенных метаболитов. Например, можно было бы лечить воспалительные заболевания кишечника, повышая уровень C. sporogenes и обеспечивать пациентам достаточное количество триптофана.
Тремя годами ранее, в 2014 году, в серии исследований другая исследовательская группа под руководством профессора Шридхара Мани также обнаружила, что индол-пропионовая кислота усиливает барьерную функцию кишечного эпителия и предотвращает воспаление путем активации PXR. индол-пропионовая кислота является лигандом PXR, а активация PXR подавляет продукцию воспалительного маркера фактора некроза опухоли альфа (TNF-α), при увеличении синтеза белка, который усиливает межклеточные контакты эпителиальных клеток кишечника.
«Путем добавления пробиотиков в форме бактерий, продуцирующих индол-пропионовую кислоту, в кишечник или путем непосредственного введения индол-пропионовой кислоты, мы в состоянии предотвратить или лечить различные воспалительные заболевания, связанные со снижением барьерной функции кишечника (диабет, астма, аллергия, ожирение)», - высказал предположение д-р Мани. К сожалению, производство пробиотика на основе C. Sporogenes пока находится только в планах ученых. Определенные преимущества есть у той части людской популяции, кишечники которой уже колонизированы C. Sporogenes и соответственно метаболизм триптофана идет с образованием индол-пропионовой кислоты.
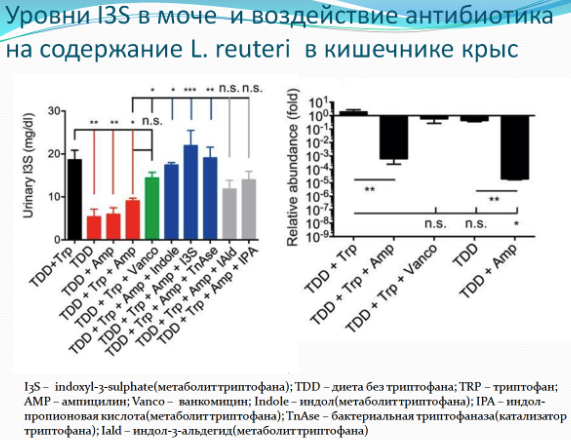
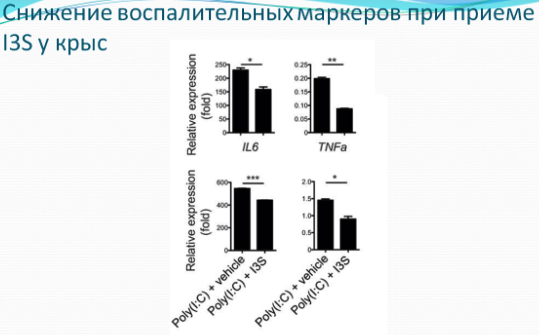 Еще одно из свойств ароматических производных триптофана, синтезируемых кишечной микробиотой - это стимуляция каскада интерферона I типа. Интерфероны I типа, кроме противовирусных эффектов, подавляют воспаление, в том числе, в головном мозге. Сигнализация интерферона-бета оказывает действие на астроциты, снижая воспаление при аутоиммунных реакциях в мозге, например, при рассеянном склерозе. Метаболиты триптофана ограничивают воспаление в ЦНС, воздействуя на астроциты. Полногеномный анализ позволил определить транскрипционный ответ на интерфероны I типа (IFN-I) в астроцитах, как в экспериментальной модели аутоиммунных реакций в центральной нервной системе (ЦНС), так и в мозге больных рассеянным склерозом. У мышей, получавших антибиотики, воспаление в ЦНС можно было снизить путем добавления агонистов AHR (метаболитов триптофана): индола, индол-3-пропионовой кислоты, индоксил-3-сульфата и индол-3-альдегида. У больных рассеянным склерозом уровень агонистов AHR в кровотоке был снижен. Ученые также высказали предложение, что штамм Lactobacillus reuteri, который принимает участие в синтезе агонистов AHR, снижался в кишечнике при терапии антибиотиками. Действительно при терапии ампициллином, содержание этих бактерий в кишечнике мышей существенно снижалось. Т.е. важна не столько сама аминокислота триптофан, присутствующая в диете, сколько состав микробиоты для синтеза определенных полезных метаболитов. Поэтому не нужно пить триптофан специально в БАДах, тем более, что его переизбыток может наоборот сокращать жизнь.
Еще одно из свойств ароматических производных триптофана, синтезируемых кишечной микробиотой - это стимуляция каскада интерферона I типа. Интерфероны I типа, кроме противовирусных эффектов, подавляют воспаление, в том числе, в головном мозге. Сигнализация интерферона-бета оказывает действие на астроциты, снижая воспаление при аутоиммунных реакциях в мозге, например, при рассеянном склерозе. Метаболиты триптофана ограничивают воспаление в ЦНС, воздействуя на астроциты. Полногеномный анализ позволил определить транскрипционный ответ на интерфероны I типа (IFN-I) в астроцитах, как в экспериментальной модели аутоиммунных реакций в центральной нервной системе (ЦНС), так и в мозге больных рассеянным склерозом. У мышей, получавших антибиотики, воспаление в ЦНС можно было снизить путем добавления агонистов AHR (метаболитов триптофана): индола, индол-3-пропионовой кислоты, индоксил-3-сульфата и индол-3-альдегида. У больных рассеянным склерозом уровень агонистов AHR в кровотоке был снижен. Ученые также высказали предложение, что штамм Lactobacillus reuteri, который принимает участие в синтезе агонистов AHR, снижался в кишечнике при терапии антибиотиками. Действительно при терапии ампициллином, содержание этих бактерий в кишечнике мышей существенно снижалось. Т.е. важна не столько сама аминокислота триптофан, присутствующая в диете, сколько состав микробиоты для синтеза определенных полезных метаболитов. Поэтому не нужно пить триптофан специально в БАДах, тем более, что его переизбыток может наоборот сокращать жизнь.
Исследование, опубликованное в выпуске «Nature Medicine» в июне 2016 года, связывает дефицит триптофана и его метаболитов с воспалением в кишечнике. Согласно исследованию полиморфизм гена, связанного с предрасположенностью к синдрому раздраженного кишечника (Card9), приводит к формированию микробиоты с нарушенной способностью генерировать метаболиты триптофана, провоцирующей возникновение колита. В своем исследовании авторы сообщили, что делеция гена Card9, центрального компонента врожденного противогрибкового иммунного ответа, делает мышей более уязвимыми перед колитом, который химически индуцирован. Исследование показало, что у мышей с нокаутом Card9 были изменены сигнальные пути иммунной связи в толстом кишечнике с сильным снижением продукции интерлейкина-22 (IL-22). Также ученые подтвердили результаты, ранее полученные на мышах, и продемонстрировали, что у пациентов с синдромом раздраженного кишечника снижена фекальная активность AHR и фекальные уровни триптофана. Авторы доказали, что это снижение коррелируется с полиморфизмом CARD9.
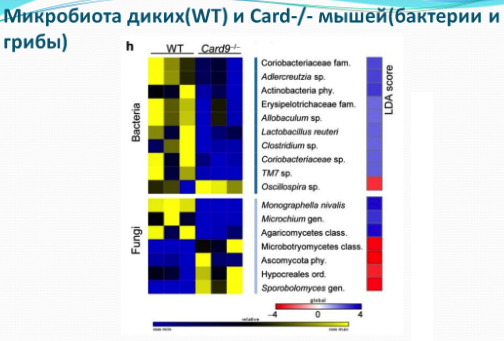
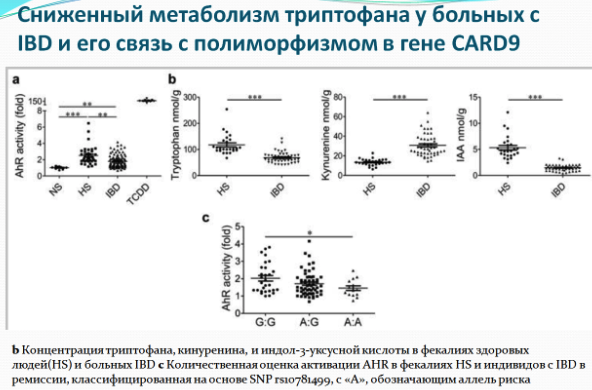
Анализ стула показал, что для микробиоты мышей Card9 - / - характерно отсутствие бактерий метаболизирующих триптофан в индольные производные, таких как Lactobacillus reuteri и Allobaculum sp. Индолы являются лигандами для арильного углеводородного рецептора (AHR), который может стимулировать локальное продуцирование IL-22 врожденными лимфоидными клетками и Т-клетками. Важно отметить, что авторы доказали, что терапия мышей (Card9 - / -) агонистом AHR была успешной. Таким образом авторы продемонстрировали, что добавление трех штаммов Lactobacilllus с высокой активностью метаболизма триптофана было достаточным для восстановления продукции IL-22 в кишечнике и для снижения восприимчивости к колиту, наблюдаемой у мышей Card9 - / -.
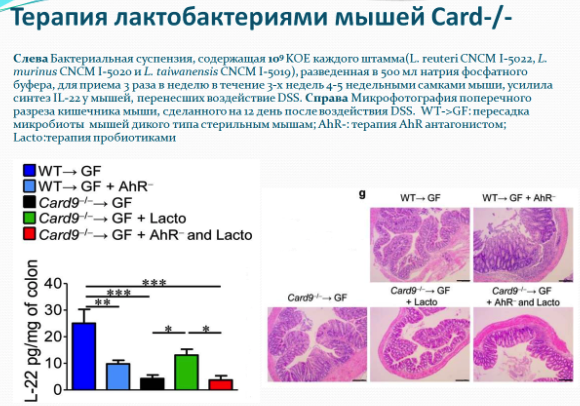
Дальнейшее исследование изменения микробиоты путем модуляции микробиоты через усиление определенных популяций бактерий, например бактерий-продуцентов триптофана и метаболитов триптофана, предоставит новые сведения для разработки индивидуальных подходов, которые могут быть использованы для профилактики и / или лечения пациентов с ишемической болезнью сердца.
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/27158906
www.sciencedaily.com/releases/2014/08/140801125050.htm
www.nature.com/articles/srep46337
www.ncbi.nlm.nih.gov/pubmed/29168502
www.ncbi.nlm.nih.gov/pmc/articles/PMC5292609
Изменения в микрофлоре могут серьезно повлиять на метаболизм триптофана от геропротекторного до сокращающего жизнь. Так у долгожителей снижается концентрация триптофана в сыворотке крови, но повышается уровень защитной для мозга кинуреновой кислоты, которой мало у больных деменцией. Важно, что у грызунов ограничение диетического приема триптофана и метионина продлевает жизнь, в то время как избыток триптофана может быть токсичным и канцерогенным. Поэтому не нужно повышать потребление триптофана, а нужно улучшать состав микрофлоры.
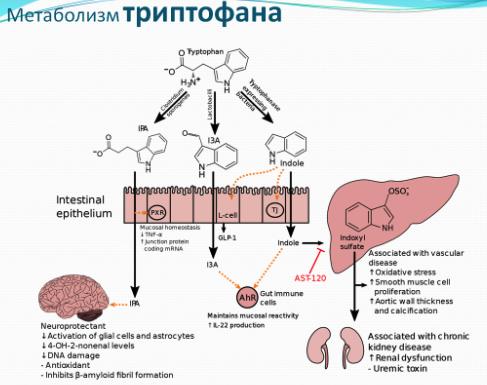
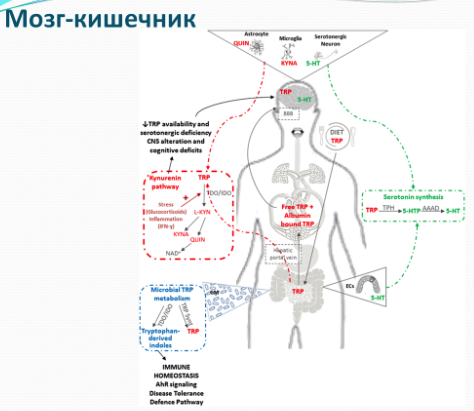
Триптофан метаболизируется в кишечнике двумя основными путями в серотонин и кинуренин. 95% синтезированного серотонина остается в желудочно кишечном тракте, и лишь небольшая его часть 5% попадает в центральную нервную систему (ЦНС). В желудочно-кишечном тракте серотонин ответственен за подвижность, секрецию и абсорбцию, а также стимулирует вагусные афферентные пути, связанные с уменьшением ожирения и метаболической дисфункции. В основном свободный триптофан метаболизируется в хинолическую и кинуреновую кислоту, которые представляют особый интерес для нейрогастроэнтерологии, поскольку они являются нейроактивными метаболитами, которые действуют на рецепторы N-метил-d-аспартата (NMDA) и альфа-7 никотиновых ацетилхолина в ЦНС. В ЦНС кинуреновая кислота уже давно рассматривается как нейропротективная, а хинолиновая кислота в первую очередь считается агонистом эксайтотоксического NMDA-рецептора. Внутри желудочно-кишечного тракта обе молекулы, по-видимому, участвуют в иммунорегуляции, и в частности кинуреновая кислота обладает противовоспалительными свойствами. Микробиом, как мы выяснили уже ранее, является ключевым игроком в метаболизме триптофана, и связан с регуляцией таких процессов как познание и возбуждение. Более того, некоторые бактериальные штаммы способны синтезировать триптофан и продуцировать серотонин из триптофана in vitro. Триптофан через путь кинуренина участвует в биосинтезе никотинамидадениндинуклеотида (НАД +), который играет ключевую роль в здоровье человека, поскольку он является важным коэнзимом для клеточных процессов энергетического метаболизма, защиты клеток и биосинтеза. А также, например, никотинамид рибозид (донор НАД+) продлевал жизнь престарелым мышам.
Индоламин-2,3-ди-оксигеназа (IDO) представляет собой фермент, индуцированный интерфероном-γ, вовлеченный в катаболизацию триптофана к кинуренину, уровень которого был выше у девяностолетних, чем у молодых. Следственно воспаление может провоцировать синтез IDO, приводя к усилению метаболического пути триптофана кинуренин. Метаболиты триптофана, полученные индукцией IDO, недавно были идентифицированы как селективные агонисты арильного углеводородного рецептора (АХR). AHR, как мы уже знаем, играют важную роль в различных физиологических процессах, включая химическую / микробную защиту и развитие тканей организма.
Изменения в составе микробиома на протяжении всей жизни могут серьезно повлиять на синтез и метаболизм триптофана.
- У долгожителей усиливается экспрессия генов, вовлеченных в пути метаболизма триптофана.
- У долгожителей повышается уровень Индоламин-2,3-ди-оксигеназа необходимой для синтеза кинуренина, что снижает уровень триптофана в крови.
- Важно отметить, что у грызунов ограничение диетического приема триптофана и метионина может оказать благотворное влияние на продолжительность жизни, в то время как избыток триптофана может быть токсичным и канцерогенным.
- То есть у долгожителей триптофан снижается из-за метаболизма, а у грызунов снижение пищевого триптофана продлевает жизнь.
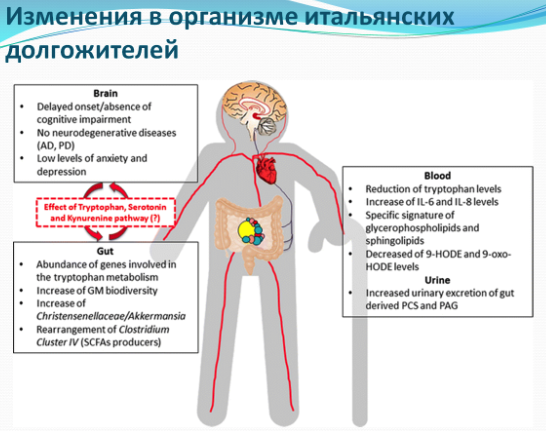
- Важно заметить, что одинаково низким триптофан был в крови у людей при деменции и у долгожителей. Различие лишь в том, что при деменции был низким метаболит кинуренина - кинуреновая кислота (KYNA), а у долгожителей уровень KYNA был оптимально высоким и играл защитную для мозга функцию.
- Эти данные приобретают особое значение ввиду того, что у долгожителей почти не наблюдается признаков болезни Альцгеймера или Паркинсона. Кроме того, у большинства долгожителей наблюдается низкий уровень тревоги и депрессии
Ссылки на исследования:
- www.ncbi.nlm.nih.gov/pubmed/20639188
- www.ncbi.nlm.nih.gov/pubmed/20639188
Раковые клетки способны уходить от иммунной системы, снижая эффективность ее работы. Иммунотерапия усиливает антираковый иммунитет. А присутствие в кишечнике мышей бактерий Akkermansia muciniphila повышает эффективность иммунотерапии. Напротив, у людей повреждение микрофлоры антибиотиками, до или после иммунотерапии, атакует полезные бактерии и снижает эффективность иммунотерапии с 40% до 20%. И предполагается, что пробиотики, например, кефир, могут повышать эффективность иммунотерапии. В итоге не нужно бесконтрольно использовать антибиотики, а также желательно регулярно употреблять кефир.
Доклинические исследования на мышах показали, что микробиота животных способна модулировать иммунный ответ на химиотерапию рака. Иммунотерапия является относительно новым подходом к лечению рака, и она направлена на естественную способность иммунной системы находить и убивать раковые клетки. Но, как оказалось, микробы, обитающие в кишечнике, могут существенно повлиять на конечный результат лечения. Организм имеет врожденный механизм борьбы с дефектными клетками. Одним из них является то, что дефектные клетки подают сигналы, которые получают клетки иммунной системы и затем выявляют и устраняют больные клетки. Но иммунная система также связана с механизмами, называемыми контрольные точки иммунного ответа, которые препятствуют тому, чтобы ответ был слишком сильным и причинял сопутствующий вред нормальным здоровым клеткам.
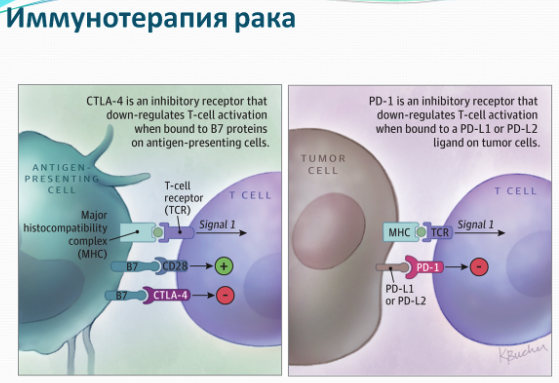
Тем не менее, раковые клетки способны использовать эти контрольные точки иммунного ответа, чтобы уйти от наблюдения иммунной системы. Но один из подходов, называемый иммунотерапией против PD-1, направлен на блокирование способности раковых клеток использовать один из путей контрольных точек иммунного ответа. В 2015 году исследователи, работавшие с мышами, доказали, что у мышей получавших антибиотики выживаемость при лечении блокаторами PD-1 была ниже. Специалисты заинтересовались выводами исследований, однако отнеслись к ним с осторожностью: невозможно просто экстраполировать результаты на людей.
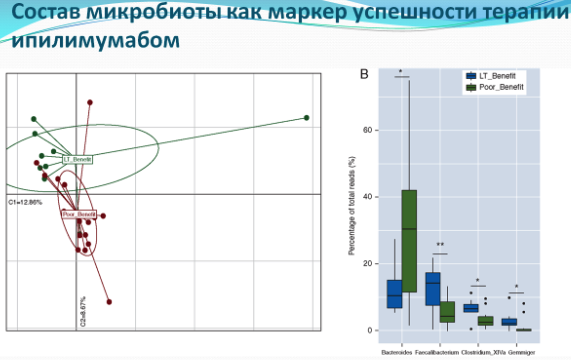
Результаты привлекли внимание сразу нескольких исследователей, которые решили проверить влияет ли антибиотикотерапия на успешность лечения блокаторами PD-1 у людей. Группа под руководством иммунолога Лоранс Зитвогель из Института онкологии имени Густава-Русси(именно она в 2015 года доказала наличие воздействия микробиоты мышей на химиотерапию), показала, что люди, незадолго (или вскоре после начала иммунотерапии) принимавшие антибиотики для лечения инфекций, также не столь успешно реагировали на терапию, блокирующую PD-1. Исследователи также обнаружили, что присутствие в кишечнике бактерий вида Akkermansia muciniphila у мышей и людей коррелировалось с успешной реакцией на иммунотерапию. Учёные изучили данные 249 пациентов, больных раком лёгких, почек и мочевого пузыря. 69 пациентов принимали антибиотики по некоторым не связанным с лечением рака причинам (лечили зубы или инфекции мочевыводящих путей) до или вскоре после введения препарата, блокирующего PD-1. У пациентов, принимавших антибиотики, нарушающие баланс кишечной микробиоты, была негативная реакция на лекарство и очень высокая смертность. После этого открытия группа Зитвогель решила сравнить состав кишечной микробиоты у пациентов, которые хорошо или же негативно отреагировали на препарат-блокатор. В результате у пациентов, которые успешно реагировали на терапию, они обнаружили бактерию A. muciniphila. Как было установлено ранее, этот вид, расщепляющий муцин, может защищать человека от ожирения и диабета. Когда стерильным мышам, трансплантировали фекалии «успешных» пациентов, они лучше прочих грызунов реагировали на блокаторы PD-1.
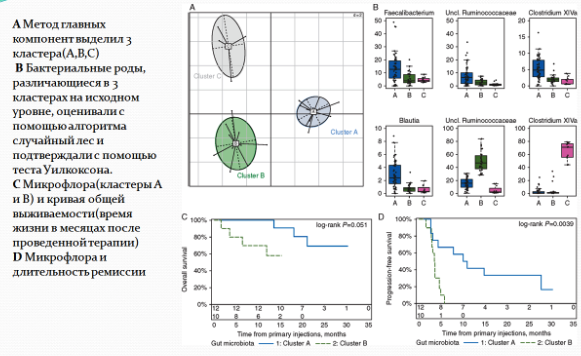
Другой исследователь - Дженнифер Варго из Онкологического центра имени М. Д. Андерсона, увидевшая презентацию работы Лоранс Зитвогель на одной из конференций, также решила провести исследование с участием людей. Варго совместно с другими специалистами собрала образцы у 112 человек с метастатической формой меланомы. Исследователи провели забор образцов до того, как пациенты начали лечение анти-PD-1 иммунотерапевтическими препаратами. Не смотря на то, что такое лечение дает хорошие результаты, только 25% пациентов положительно реагируют на препараты, которые нацеливаются на PD-1, но согласно данным Зитвогель, результативность терапии можно повысить до 40%, отказавшись от использования антибиотиков при приеме блокаторов PD-1. Варго обнаружила, что пациенты, у которых альфа-разнообразие было выше, лучше реагировали на иммунотерапию, а у стерильных мышей после фекальной трансплантации микробиоты этих пациентов также замедлился рост опухоли при иммунотерапии. Варго далее планирует изучить, действительно ли регулирование кишечной микробиоты при помощи фекальных трансплантаций или бактериальных интервенций может помочь пациентам с меланомой лучше реагировать на PD-1. Подобные испытания должны начаться в ближайшем будущем.
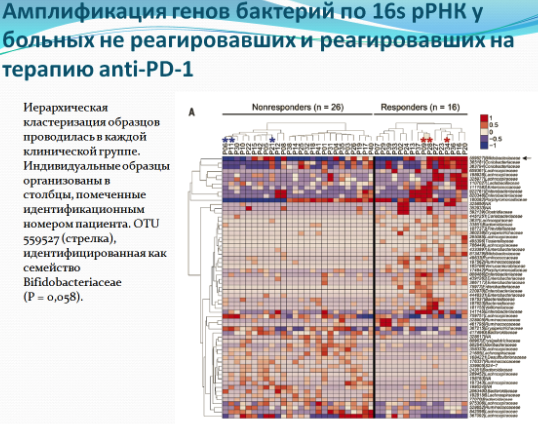
Томас Гаевски в своей работе, опубликованной в журнале Science, пришел к выводу, что за успешность иммунотерапии меланомы отвечают некоторые штаммы бактерий, в норме присутствующие в кишечнике. Гаевски собрал образцы кала у 42 пациентов, страдающих тяжелой формой меланомы, до того, как им была проведена иммунотерапия. Большинство пациентов (38 человек) получали препараты против PD-1, такие как Ниволумаб или Пембролизумаб. Оставшиеся пациенты (4 человека) получали Ипилимумаб, связывающий антиген CTLA-4. У пациентов, которые реагировали на иммунотерапию, в микробиоте был меньший процент патогенных бактерий, а из позитивной микрофлоры наибольшее влияние оказывали следующие бактерии - Enterococcus faecium, Bifidobacterium longum и Collinsella aerofaciens . Затем исследователи провели эксперимент по трансплантации микробиоты из кишечника пациентов в кишечник стерильных мышей, а через 2 недели трансплантировали этим мышам опухоли меланомы. Опухоли росли медленнее у тех мышей, которые получали кишечные бактерии у людей, с положительным ответом на иммунотерапию - у двоих из трех мышей рост опухоли замедлился. У мышей, донорами которых были пациенты, не реагирующие на иммунотерапию, только у одной были признаки медленного роста опухоли, в то время как у двух других были быстрорастущие опухоли. Т.е. результаты исследования Варго также были подтверждены этой командой. Теперь исследователи хотят проверить, могут ли пробиотики стимулировать иммунотерапию и планируют клиническое исследование с использованием Bifidobacteria. Они также надеются расширить список полезных и потенциально опасных бактерий кишечника у больных раком, и собираются выяснить как микроорганизмы взаимодействуют со способностью иммунной системы контролировать рак.
Ссылки на исследования:
- http://science.sciencemag.org/content/early/2017/11/01/science.aan3706
- http://science.sciencemag.org/content/early/2017/11/01/science.aan4236
- www.ncbi.nlm.nih.gov/pubmed/28368458
- http://science.sciencemag.org/content/359/6371/104
Микрофлора японских, итальянских и китайских долгожителей (более 100 лет жизни) значительно разнообразнее и по составу более здоровая, чем у молодых, а также пожилых людей, не достигших столетнего возраста. Микробиота, похоже, мало меняется во взрослом и в пожилом возрастах (20-70 лет), а в возрасте примерно 90-100 лет претерпевает глубокое и, возможно, адаптивное к старению изменение. Такое разнообразие свойственно людям, употребляющим в пищу много круп, зелени, свежих овощей и бобовых.
В данном случае под долгожителями понимаются люди от 100 лет и старше. Есть регионы, где плотность таких долгожителей выше - Япония и некоторые области южной Европы. Считается, что типичная диета, потребляемая в этих областях, способствует продлению жизни. В диете ли дело, либо в образе жизни, либо в медицине - это уже другой вопрос. Но так или иначе и диета, и физическая активность, и уровень медицины - все это может влиять на микрофлору. При изучении возрастного ремоделирования человеческого микробиома одним из наиболее сложных аспектов является изоляция изменений микробиоты, косвенно связанных со старением, как таковым из-за перемен в диете и образе жизни. Потеря зубов, проблемы с жеванием и глотанием, старческое снижение обоняния, вкуса и физической активности сильно влияют на качество диеты и образ жизни, а эти факторы в свою очередь являются факторами, определяющими состав и функциональность микробиоты. Поэтому эффективной стратегией изучения микробиома пожилых людей является сравнение пожилых и долгоживущих людей с различными стилями питания, образом жизни и культурными особенностями между собой.
Недавнее исследование, проведенное ассистентом профессора Цзянчао Чжао (США), позволило выявить новые особенности здоровой микробиоты китайских долгожителей. Исследователи сравнили кишечный микробиом здоровых китайских столетних долгожителей и девяностолетних (90-99 лет) (n = 67) с более молодыми людьми, включая 54 пожилых и 47 молодых людей, а также с результатами предыдущего исследования микробиоты итальянских столетних долгожителей (100-104 лет) (n = 15) и супердолгожителей (105-109 лет) (n = 24).
Наборы данных из китайских и итальянских исследований были объединены и повторно проанализированы. Наблюдались значительные различия в микробном сообществе и в структурах сообщества между итальянскими и китайскими долгоживущими группами, которые можно отнести к влиянию географических, генетических и пищевых факторов. Несмотря на эти различия, в обеих группах были выявлены общие черты, которые отличали микробиоту долгожителей от микробиоты молодых людей. Альфа-разнообразие было одной из главных черт, отличавшей долгожителей от более молодых людей: долгожители отличались от младшей группы как большим числом видов микробов в сообществе, так и большей видовой насыщенностью. Наконец, микробиом долгоживущих групп, как в итальянской, так и в китайской когортах, был обогащен родами Ruminococcaceae, Akkermansia и Christensenellaceae, которые классифицируются как потенциально полезные бактерии, связанные с уменьшенным индексом массы тела, иммуномодуляцией и здоровым гомеостазом.
Другая статья, представляющая результаты секвенирование Illumina генов 16S рРНК, микробиома долгожителей, живущих в одной из самой насыщенной по плотности долгожителей местности в мире (округ Бама, Китай), подтвердило, что микробиом долгожителей был более разнообразным (количество уникальных номеров OTU), чем у пожилых людей, не достигших столетнего возраста. Эти результаты вошли в противоречие с результатами предыдущего исследования, которое свидетельствовало, что микробное разнообразие у долгожителей было значительно снижено. Однако эти различия могут быть вызваны ограничениями использованной в предыдущем исследовании технологии (ДНК-микрочипов). Изучая особенности фекальных микробных сообществ долгожителей округа Бама, авторы исследования обнаружили определенное сходство с микробиомами итальянских долгожителей (обилие Escherichia, сокращение бактероидов, структурные изменения в бактериях, продуцирующих бутират) и некоторые отличия (низкий уровень Akkermansia).
Еще одно исследование, теперь уже японское, подтвердило выводы предыдущих исследований. Важно отметить, что снижение уровня Faecalibacterium, Roseburia, Coprococcus, Blautia и увеличение Enterobacteriaceae у 90- и 100-летних испытуемых напоминало возрастные изменения микробиоты, обнаруженные у итальянских долгожителей, и несколько отличалось от изменений микробиоты китайских долгожителей. Что касается разнообразия микробиома, то в японской когорте показатель альфа-разнообразия и индекс Шеннона оставались стабильными в зрелом возрасте, а затем увеличивались у пожилых и долгожителей.
Сравнение микробиоты молодых, пожилых людей и долгожителей показало, что изменения в составе и разнообразии экосистемы кишечника не линейно связано с возрастом, микробиомы молодых и 70-летних достаточно схожи между собой и заметно отличаются от долгожителей. Таким образом, микробиота, похоже, мало меняется во взрослом и в пожилом возрастах (20-70 лет), а в возрасте примерно 90-100 лет в симбиотической ассоциации с хозяином она претерпевает глубокое и, возможно, адаптивное ремоделирование. Необходимы дальнейшие исследования, чтобы заполнить возрастной разрыв между 70 и 100 годами и отследить перестройку возрастных изменений микробиома.

Микробиом взрослого человека, состоящий из доминирующих симбиотических бактериальных таксонов (Ruminococcaceae, Lachnospiraceae, Bacteroidaceae), постепенно теряет разнообразие и относительное обилие своих членов с увеличением возраста хозяина. У супердолгожителей эти изменения уравновешиваются увеличением адаптивных к долголетию и, возможно, благоприятных для здоровья субдоминантных видов, например, Akkermansia, Bifidobacterium, Christensenellaceae. Кроме того, микробиом супердолгожителей отличается наличием микроорганизмов, характерных для других ниш, таких как Mogibacteriaceae и Synergistaceae, которые, как известно, хорошо себя чувствуют и размножаются в полости рта.
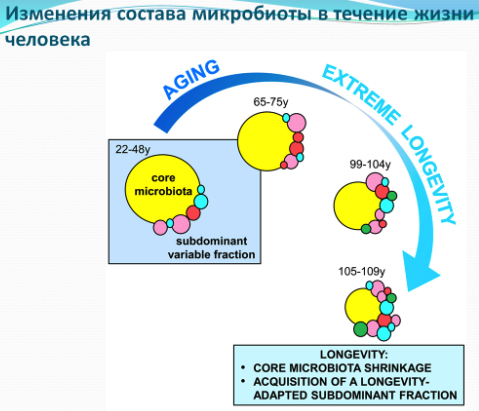
У чрезвычайно пожилых людей, долгожителей и супердолгожителей наблюдалось общее увеличение в разнообразии микробиома. Таким образом, не смотря на то, что долгожители теряют некоторые из важнейших кластерных компонентов взрослого микробиома, они приобретают параллельно множество новых микробных компонентов, включая потенциальные патогены и аллохтонные микроорганизмы. Кажется, что экосистема кишечника супердолгожителей претерпевает изменения, приобретая свойства, характерные для микробиома доиндустриального человека. В частности высокое разнообразие, и видовою насыщенность микроорганизмов, обычно рассматриваемых как патобионты, например, Prevotella, Treponema, Bacteroidetes и Clostridiales . Например, микробиота охотников-собирателей Хадза из Танзании демонстрирует уникальное разнообразие метаболических путей, которые согласуются с диетическими и экологическими факторами, свойственными их кормовому образу жизни, характеризующемуся широким спектром углеводного обмена, что отражает обилие сложных углеводов в рационе Хадза во время сезона дождей. Но их пищеварительная система также хорошо приспособлена для расщепления аминокислот с разветвленной цепью и биосинтеза ароматических аминокислот, характерных для их рациона в течение сухого сезона. На основании этих исследований мы можем предположить, что долгожители могут «перезагружать» свою микробиоту, по крайней мере, частично изменив микробные паттерны на те, которые поддерживают здоровье хозяина. Остается узнать, как эти люди достигают этой цели, и какие генетические факторы хозяина участвуют в этом адаптивном процессе.
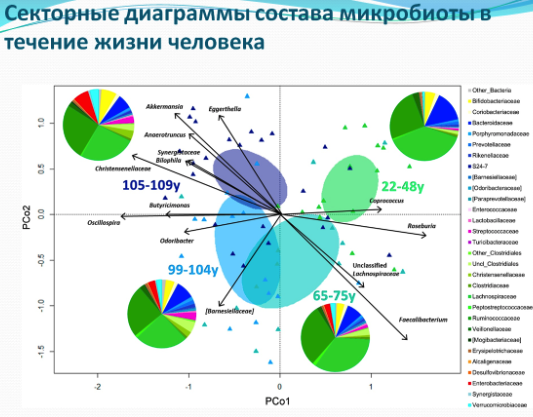
Bacteroidetes и Firmicutes по-прежнему доминируют в микробиоте долгожителей, но подгруппы Firmicutes проходят через специфические изменения с уменьшением кластера рода Clostridium и бутират продуцирующих бактерий(Ruminococcus obeum, Roseburia intestinalis, Eubacterium ventriosum, Eubacterium rectale, Eubacterium hallii, Papillibacter cinnamovorans., Faecalibacterium prausnitzii) , а также большим разнообразием видов Bacillus.
Микробиота долгожителей обогащается факультативными анаэробными бактериями, которые в основном принадлежат к Proteobacteria, которые были переопределены как «потенциальные патогены». Связанное с возрастом ремоделирование микробиома (то есть распространение оппортунистических Proteobacteria за счет симбионтов Firmicutes и Bacteroidetes) может способствовать воспалению и зависит от системного воспалительного статуса в виде самоподдерживающейся цепной реакции. Действительно, изменения в профиле микробиома, наблюдаемые у долгожителей, коррелируются с увеличением провоспалительных цитокинов в периферической крови. В частности, у них высокие уровни IL-6 и IL-8, которые можно связать с распространением Proteobacteria и уменьшением количества определенных бактерий, продуцирующих бутират.
В общей сложности 50 параметров, включая бактериальные операционные таксономические единицы измерения -Оту и альфа-разнообразие, из объединенного китайского и итальянского набора данных дифференцировали долгоживущих людей от других людей. В частности, 11 параметров были одинаковы для пожилых людей в китайском и итальянском исследованиях, включая общинное богатство членов Blautia, Clostridium, Faecalibacterium, Escherichia_Shigella и неклассифицированных Lachnospiraceae, Ruminococcaceae и Erysipelotrichaceae.
OTU, обогащенные долгоживущими группами как в китайских, так и в итальянских когортах, были потенциально полезными бактериями, в том числе членами кластера Clostridium IVa, состоящими из многих бактериальных родов, участвующих в производстве короткоцепочечных жирных кислот, и Ruminococcaceae, Akkermansia и Christensenellacea. Более высокое микробное разнообразие кишечника и обогащение несколькими потенциально полезными бактериальными видами в двух разных когортах долгожителей указывают на правдоподобную связь между здоровым старением и особенностями микробиоты кишечника человека. Необходимы дальнейшие исследования для выяснения его роли в качестве причины или следствия здорового старения и того, эффективны ли таргетинг кишечных микробов в продвижении долголетия.
Вероятно, у долгожителей состав, функциональность и разнообразие этого сложного и динамичного микробного сообщества, достигают своеобразного баланса в результате непрерывного 100-летнего процесса ремоделирования. Таким образом, еще предстоит определить, как адаптированный микробиом способствует гомеостазу пожилого хозяина, позволяя ему достичь максимального на данный момент предела человеческой жизни.
Ссылки на исследования:
- https://linkinghub.elsevier.com/retrieve/pii/S0960-9822(16)30338-4
- https://link.springer.com/article/10.1007/s00018-017-2674-y
- www.ncbi.nlm.nih.gov/pmc/articles/PMC4879732/
- www.ncbi.nlm.nih.gov/pubmed/27185560
Выводы:
- Когда еда и диетическое волокно из овощей или бобовых попадают в кишечник, в результате метаболизма бактерий активируется Gpr41, который уменьшает кровяное давление на величину от 3,98 до 6.12 мм рт. ст. Также снижает немного артериальное давление при употреблении пробиотиков (например, кефира).
- Короткоцепочечные жирные кислоты, синтезируемые микрофлорой кишечника при употреблении бобовых и овощей, снижают разрушение костей.
- Бутират, который синтезируется микрофлорой при употреблении овощей и бобовых, может снижать риск рака толстой кишки, опухоли мозга, способен влиять на продолжительность жизни животных, изменяя работу генов.
- Добавление колановой кислоты в среду культивирования человеческих клеток, а также в пищу червей или лабораторных плодовых мушек увеличивало продолжительность жизни животных и, соответственно, человеческих клеток.
- Сульфорафан из капусты брокколи и других крестоцветных овощей + модифицированные бактерии E. coli , возможно, помогут в будущем избавить человечество от рака толстой кишки.
- Пересадка донорского кала поможет в будущем создать таблетки, которые омолодят нашу микрофлору до состояния молодого человека и продлят нашу жизнь.
- В будущем в нашей микрофлоре управляемый синтез индола будет замедлять возрастное одряхление организма и, возможно, продлевать жизнь.
- Диета, богатая продуктами из цельного зерна за счет содержания триптофана, увеличивает концентрацию индол-пропионовой кислоты и защищает людей от сахарного диабета 2-го типа, и снижает накопление бета-амилоидных бляшек (важного фактора развития болезни Альцгеймера)
- Изменения в микрофлоре могут серьезно повлиять на метаболизм триптофана от геропротекторного до сокращающего жизнь. Так у долгожителей снижается концентрация триптофана в сыворотке крови, но повышается уровень защитной для мозга кинуреновой кислоты, которой мало у больных деменцией. Важно, что у грызунов ограничение диетического приема триптофана и метионина продлевает жизнь, в то время как избыток триптофана может быть токсичным и канцерогенным. Поэтому не нужно повышать потребление триптофана, а нужно улучшать состав микрофлоры.
- Раковые клетки способны уходить от иммунной системы, снижая эффективность ее работы. Иммунотерапия усиливает антираковый иммунитет. А присутствие в кишечнике мышей бактерий Akkermansia muciniphila повышает эффективность иммунотерапии. У людей, напротив, повреждение микрофлоры антибиотиками до или после иммунотерапии атакует полезные бактерии и снижает эффективность иммунотерапии с 40% до 20%. И предполагается, что пробиотики (например, кефир) могут повышать эффективность иммунотерапии. В итоге не нужно бесконтрольно использовать антибиотики, а также желательно регулярно употреблять кефир.
- Микрофлора японских, итальянских и китайских долгожителей (более 100 лет жизни) значительно разнообразнее и по составу более здоровая, чем у молодых, а также у пожилых людей, не достигших столетнего возраста. Микробиота, похоже, мало меняется во взрослом и в пожилом возрастах (20-70 лет), а в возрасте примерно 90-100 лет претерпевает глубокое и, возможно, адаптивное к старению изменение. Такое разнообразие предположительно свойственно людям, употребляющим в пищу много круп, зелени, свежих овощей, бобовых.