Мелатонин - Камертон старения
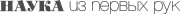 : 17 Сен 2007 , Алмазный путь длиною в три миллиарда лет , том 16, №4
: 17 Сен 2007 , Алмазный путь длиною в три миллиарда лет , том 16, №4Смена дня и ночи, света и темноты - одно из наиболее существенных природных явлений на Земле. Вращение нашей планеты вокруг своей оси и одновременно вокруг Солнца отсчитывает сутки, сезоны и годы человеческой жизни. Биологическими часами организма служит эпифиз (шишковидная железа), его гормон мелатонин можно уподобить маятнику, который обеспечивает ход этих часов. Трудно переоценить роль, которую играет наш природный хронограф в регуляции физиологических ритмов организма и их адаптации к условиям внешней среды...
Честь открытия этого гормона принадлежит А. Лернеру, дерматологу из Йельского университета. В 1953 г. ему удалось выделить из бычьих эпифизов экстракт, благодаря которому кожа лягушки становилась более светлой. Исследователь и его коллеги переработали 250 тысяч эпифизов, чтобы получить ключевой компонент - активную субстанцию, которая была идентифицирована как N-ацетил-5-метокситриптамин.
Первооткрыватель дал новому гормону более романтичное имя «мелатонин» (от греческих слов melas - черный и tosos - труд) и представил свое открытие на суд общественности в одностраничной статье, опубликованной в 1958 г. в Journal of American Chemical Society .
Наши «солнечные часы»
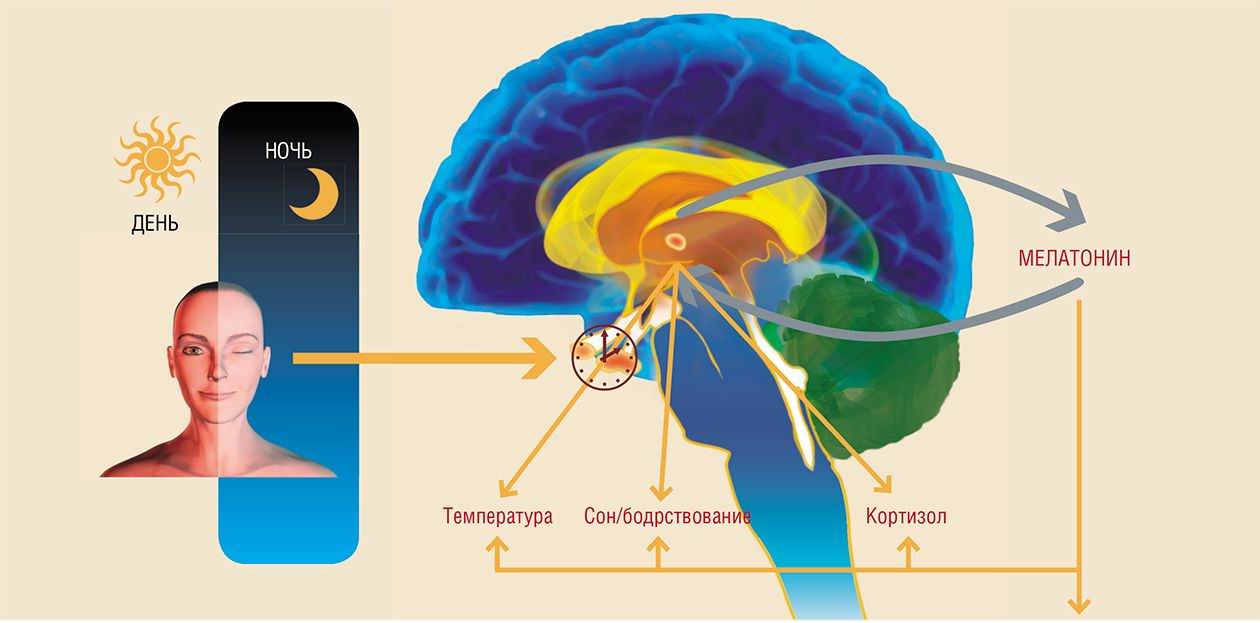
Эпифиз - нейроэндокринный орган, основной функцией которого является передача информации о световом режиме окружающей среды во внутреннюю среду организма, - обнаружен у всех позвоночных.
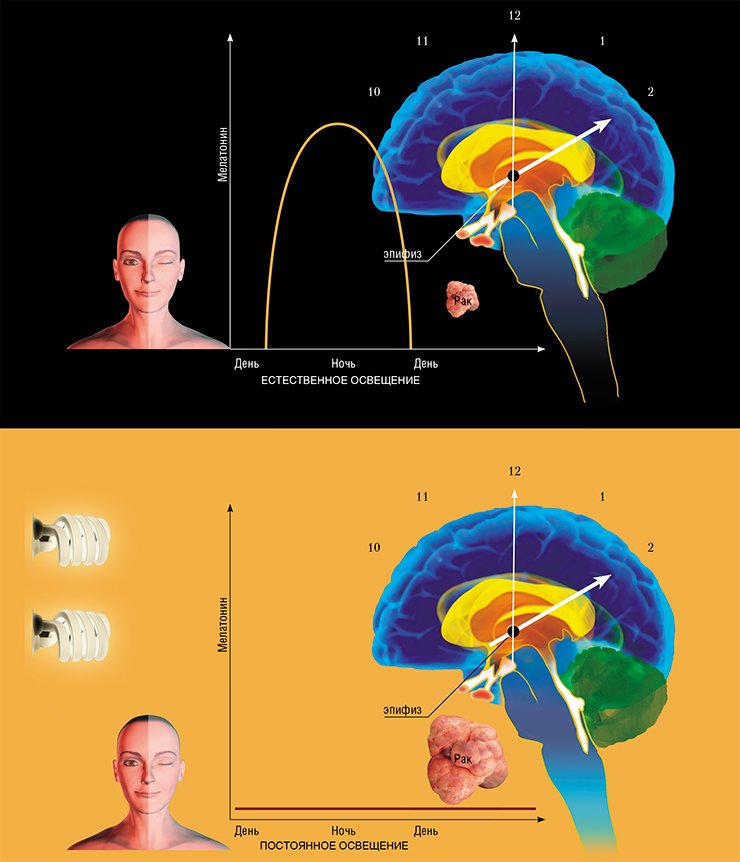
Гормон мелатонин, выделяемый нашими «биологическими часами» - эпифизом - в темное время суток, играет важнейшую роль в реализации противоопухолевого иммунитета
Необходимо отметить, что в организме присутствует и экстрапинеальный мелатонин , то есть мелатонин, синтезированный вне эпифиза. Открытие последнего связано с российскими учеными Н. Т. Райхлиным и И. М. Кветным, которые в 1974 г. установили, что способностью синтезировать мелатонин обладают и клетки червеобразного отростка кишечника. Выяснилось, что мелатонин образуется и в других отделах желудочно-кишечного тракта, а также в печени, почках, желчном пузыре, яичниках, плацентах, тимусе, в клетках крови (лейкоцитах, тромбоцитах) и т. д. Биологическое действие экстрапинеального мелатонина реализуется непосредственно там, где он синтезируется.
Пожалуй, наиболее точным было бы сравнение эпифиза с солнечными часами, в которых мелатонин играет роль тени от гномона - стержня, который служит для определения высоты солнца. Днем светило высоко и тень коротка (соответственно, уровень мелатонина минимален), с наступлением темноты синтез мелатонина эпифизом и его секреция в кровь возрастают. Таким образом, концентрация мелатонина имеет суточный ритм, определяемый хронологическим метрономом - вращением Земли вокруг своей оси.
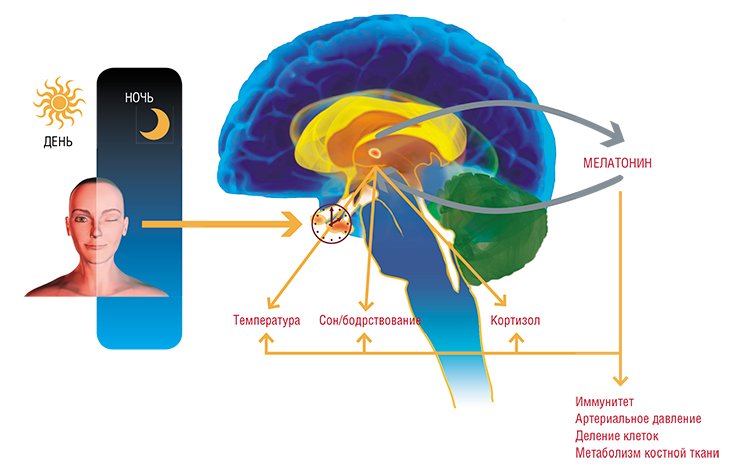
Физиологический контроль эндокринной функции эпифиза у человека и животных в значительной мере осуществляется световым режимом. Световая информация, воспринимаемая через глаза, передается в эпифиз по нейронам супрахиазматического ядра (СХЯ) гипоталамуса. В темное время суток сигналы от СХЯ вызывают увеличение синтеза и высвобождение норадреналина из симпатических окончаний. Этот нейромедиатор возбуждает рецепторы, расположенные на мембране пинеалоцитов (клеток эпифиза), стимулируя синтез мелатонина. Этот нейрогормон, в свою очередь, оказывает значительное влияние на многие физиологические функции организма
В рамках суточного ритма организма мелатонин поддерживает цикл сна-бодрствования организма, а также суточные изменения двигательной активности и температуры тела. Концентрация его в крови достигает своего максимума за 1-2 часа до пробуждения: именно в это время сон человека наиболее глубок, а температура тела достигает своего минимума.
Электричество, вошедшее в нашу жизнь более ста лет назад, кардинально изменило световой режим. Воздействие света на человека в ночное время, часто называемое световым загрязнением , стало существенной частью современного образа жизни, для которого характерно множество серьезных расстройств поведения и состояния здоровья, включая сердечно-сосудистые заболевания и рак. Согласно гипотезе циркадианной деструкции , длительное использование дополнительного освещения нарушает внутренний суточный ритм, подавляет ночную секрецию мелатонина, что приводит к снижению его концентрации в крови.
Ночной охранник мелатонин
Показано, что освещенность в 1,3 лк монохромного синего света (или в 100 лк белого света) может значительно подавить продукцию мелатонина эпифизом. Значительное снижение уровня мелатонина было обнаружено у добровольцев, которых подвергали прерывистому воздействию света в ночное время на протяжении двух недель.
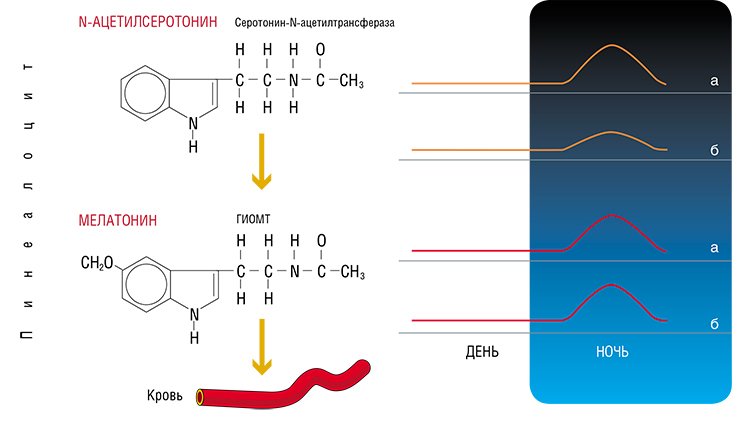
Биосинтез и суточный ритм мелатонина в пинеалоцитах (клетках эпифиза) (а) и в крови (б). Свет угнетает продукцию и секрецию мелатонина, поэтому его максимальный уровень в эпифизе и крови наблюдается в ночные часы, а минимальный - в утренние и дневные
В основе молекулярного часового механизма супрахиазматического ядра гипоталамуса (по нейронам которого в эпифиз передается световая информация) лежит взаимодействие положительных и отрицательных обратных связей между работой нескольких, по крайней мере девяти, основных «часовых генов», обеспечивающих циркадианный (околосуточный) ритм. Обнаружено, что свет напрямую воздействует на экспрессию некоторых таких генов. Те же, в свою очередь, регулируют функции ключевых генов клеточного цикла и генов апоптоза. Мутации в некоторых часовых генах драматически сказываются на многих функциях организма и приводят к развитию различных патологических процессов.
Искусственное увеличение продолжительности светового периода в течение дня даже на 2-4 часа приводит у грызунов к увеличению продолжительности эстрального цикла, а в некоторых случаях - к его нарушению. Если воздействие света на мышей и крыс увеличить до 24 часов в сутки, у большинства из них в короткие сроки разовьется синдром персистирующего (постоянного) эструса. В естественных условиях этот синдром развивается в более позднем возрасте и затем переходит в анэструс, который является физиологическим эквивалентом климакса у женщин.
В яичниках у крыс с персистирующим эструсом обнаруживают фолликулярные кисты и гиперплазию ткани яичника, в них отсутствуют желтые тела. Циклическое производство гормонов, характерное для нормального репродуктивного периода, нарушается, что приводит к гиперпластическим процессам в молочных железах и матке.
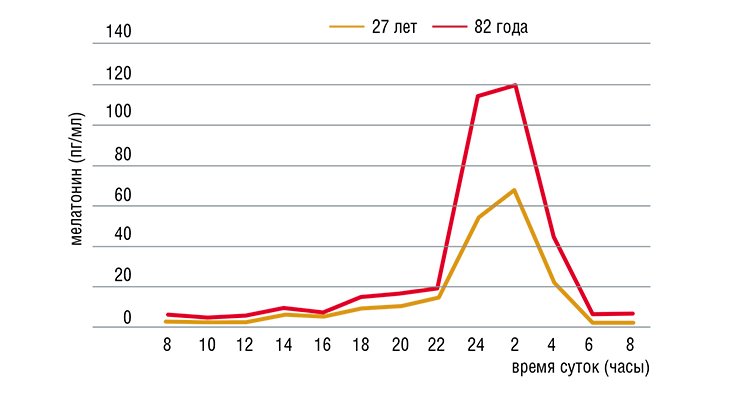
С возрастом продукция мелатонина эпифизом уменьшается, что видно по суточному ритму концентрации мелатонина в крови мужчин разного возраста
И крысы в этом отношении оказались не столь далеки от человека. Имеются данные о том, что дополнительное освещение в ночное время укорачивает продолжительность менструального цикла у женщин с длинным (более 33 дней) циклом. Так, у 60 % обследованных медицинских сестер с регулярным менструальным циклом и частой работой в ночную смену менструальный цикл был короче 25 дней, а около 70 % сестер жаловались на редкие или частые дисменореи (отсутствие менструаций).
Использование постоянного освещения приводит к увеличению порога чувствительности гипоталамуса к ингибирующему действию эстрогенов - ключевого механизма в старении репродуктивной системы как у самок крыс, так и у женщин. Таким образом, дополнительное ночное освещение способствует ускорению связанного с возрастом угасания женской репродуктивной функции.
Основные функции эпифиза в организме• Регуляция циркадианных и сезонных ритмов организма
• Регуляция репродуктивной функции
• Антиоксидантная защита организма
• Противоопухолевая защита
• «Солнечные часы старения»
У крыс с персистирующим эструсом также обнаружено снижение толерантности к глюкозе и чувствительности к инсулину. Кроме того, воздействие постоянного света на организм увеличивает интенсивность перекисного окисления липидов в тканях животных, тогда как применение мелатонина вызывает ее снижение, особенно в головном мозге.
Антиоксидантный эффект мелатонина был открыт американским ученым Р. Рейтером в 1993 г. Он обусловлен выраженной способностью мелатонина нейтрализовать свободные радикалы, в том числе такие, которые образуются при перекисном окислении липидов, а также тем, что в его присутствии активизируется глутатионпероксидаза - мощный эндогенный фактор ферментативной защиты от радикального окисления.
В течение последних 20 лет удалось установить, что мелатонин играет важнейшую роль в регуляции иммунной защиты организма, в том числе и в реализации противоопухолевого иммунитета. К настоящему моменту доказано, что рецепторы мелатонина присутствуют на мембранах многих иммунокомпетентных клеток. Удаление эпифиза или использование препаратов, подавляющих синтез мелатонина, сопровождается угнетением продукции антител, а его введение стимулирует производство лимфоцитами интерлейкинов и g-интерферона.
Ночная работа и рак
Число рабочих, имеющих ночную работу или работу по сменам, достигает одной пятой от общего числа работающих в США и в большинстве стран ЕЭС. Очевидное ухудшение здоровья у таких работников связано с нарушениями сна, желудочно-кишечными и сердечно-сосудистыми заболеваниями, нарушениями метаболизма; возможно и увеличение риска развития диабета.
Показано, что ожирение, высокий уровень триглицеридов и холестерина, а также низкая концентрация «антисклеротических» липопротеинов высокой плотности (ЛВП) обнаруживаются в этой группе чаще, чем у работающих в дневную смену. Кроме того, доказано, что эти показатели, наряду с гипертонией, сниженными фибринолитической активностью крови и толерантностью к глюкозе, являются факторами риска возникновения не только сердечно-сосудистых заболеваний, но и злокачественных опухолей. Это подтверждают данные о гораздо большем числе смертей от злокачественных новообразований у сменных рабочих, проработавших на производстве не менее 10 лет, по сравнению с рабочими, занятыми только в дневное время.
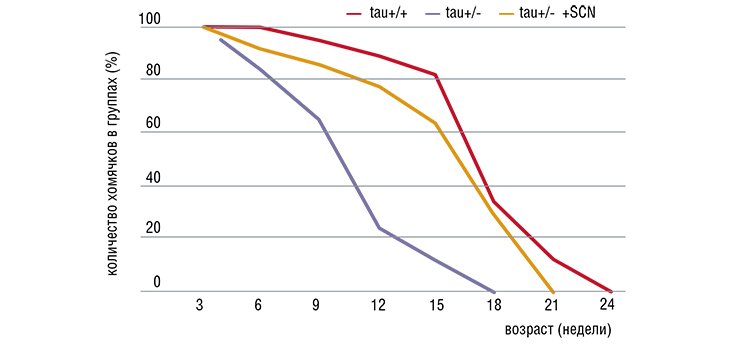
Мутации в гене tau - одном из часовых генов, работающих в клетках супрахиазматического ядра гипоталамуса, - влияют на продолжительность жизни хомячков
Повышенный риск развития рака молочных желез установлен среди медсестер, имевших стаж более 30 лет и работу по сменам, что сопровождалось снижением уровня мелатонина и повышением концентрации эстрогенов в их крови. Высокий онкологический риск характерен также для женского летного состава авиалиний и женщин других профессий, работающих в ночные смены.
Еще в 1964 г. немецкий исследователь В. Йохле обнаружил, что число опухолей молочной железы и обусловленных ими смертей у мышей, содержавшихся в помещении с круглосуточным освещением, значительно выше, чем у животных, находившихся в обычном световом режиме. Аналогичная закономерность прослеживается и в отношении других опухолей.
Через два года И. О. Смирнова, сотрудница Онкологического научного центра (Москва), обнаружила, что в молочной железе подавляющего большинства самок крыс через семь месяцев после начала воздействия на них постоянного освещения идет развитие гиперпластических процессов и мастопатий. По данным И. А. Виноградовой (Петрозаводский государственный университет), при содержании в условиях постоянного освещения до 18-месячного возраста доживает чуть больше половины самок крыс, при стандартном же освещении - почти 90 % крыс. При этом у 30 % крыс из первой группы были обнаружены спонтанные опухоли, тогда как среди крыс, содержавшихся в стандартном режиме освещения, такие опухоли встречались только у 16 %.
Сходный эффект от постоянного освещения был получен в опытах, проведенных в нашей лаборатории Д. А. Батуриным на самках мышей, несущих ген рака молочной железы HER-2/neu. У этих животных было отмечено большее число множественных аденокарцином молочной железы по сравнению с группой самок, содержавшихся при стандартном освещении. Следует отметить, что канцерогенный эффект от постоянного освещения пропорционален интенсивности последнего.
В 1965 г. И. К. Хаецкий из Института проблем онкологии (Киев) впервые сообщил о стимулирующем влиянии постоянного освещения на химически вызванный канцерогенез молочных желез у крыс. Впоследствии, в ряде работ наших и зарубежных исследователей, было доказано активирующее влияние постоянного освещения на развитие у животных опухолей различных локализаций, индуцированных канцерогенами.
При этом воздействие круглосуточного освещения необязательно должно быть постоянным. Так, при проведении наших экспериментов совместно с Д. Ш. Бениашвили крысы, подвергнутые трансплацентарному воздействию канцерогена N-нитрозоэтилмочевины, содержались в комнате с включенным светом на протяжении всей беременности и в период вскармливания детенышей, после чего потомство содержалось при обычном световом режиме. Выяснилось, что даже кратковременное воздействие постоянного освещения на грызунов способствовало в будущем развитию у них опухолей нервной системы и почек при введении канцерогена.
Лекарство против времени?
Таким образом, в результате проведения эпидемиологических и экспериментальных исследований ученые установили, что экологические и генетические факторы, которые повреждают системный и/или местный циркадианный ритм, могут ставить под угрозу временное регулирование деления клеток и усиливать рост опухолей. Но этим их негативное действие на организм не исчерпывается.
Нужно отметить, что даже при благоприятных условиях внешней среды уровень производства мелатонина в организме не остается постоянным в течение жизни. Так, у людей в возрастной группе 60-74 года большинство физиологических показателей претерпевает положительный фазовый сдвиг околосуточного ритма примерно на 1,5-2 часа вперед. У лиц старше 75 лет нередко возникает десинхронизация секреции многих гормонов, температуры тела, сна и некоторых поведенческих ритмов. С чем это может быть связано? При старении угнетаются, в том числе, и функции шишковидной железы, что проявляется, прежде всего, в нарушении ритма производства мелатонина и в снижении уровня его секреции.
Эффекты от постоянного освещения• Угнетение синтеза и секреции мелатонина
• Увеличение синтеза и секреции пролактина
• Увеличение порога чувствительности гипоталамуса к торможению эстрогенами
• Индукция ановуляции и кист яичника
• Стимуляция пролиферативных и опухолевых процессов в молочной железе и в эндометрии
• Усиление образования активных форм кислорода
• Стимуляция атеросклероза и развития метаболического синдрома
Если эпифиз - солнечные часы организма, то очевидно, что любые изменения длительности светового дня должны существенным образом сказываться на его функциях и, в конечном счете, на скорости старения. И действительно: в ряде работ было показано, что нарушение фотопериодичности может приводить к существенному уменьшению продолжительности жизни.
Американские исследователи М. Хард и М. Ральф обнаружили, что у золотистых хомячков с особой мутацией в гене, отвечающем за генерацию ритмических сигналов в супрахиазматическом ядре гипоталамуса (а именно этими сигналами задается ритм производства мелатонина), продолжительность жизни была на 20 % ниже, чем у контрольной группы животных. Этот эффект удалось полностью устранить, имплантировав клетки гипоталамуса эмбрионов здоровых хомячков в головной мозг старых мутантных хомячков.
К сокращению продолжительности жизни животных приводит и экспериментальное разрушение супрахиазматического ядра. Это неудивительно, ведь в этих ядрах свою активность проявляет целый набор уже упоминавшихся «часовых» генов. Нарушение функции одного из них ( Per2 ) вызывает преждевременное старение мышей и увеличивает их чувствительность к развитию опухолей. Мутации в другом гене циркадианного ритма ( Clock ) приводят к развитию ожирения и метаболического синдрома, а также к преждевременным нарушениям репродуктивного цикла у мышей.
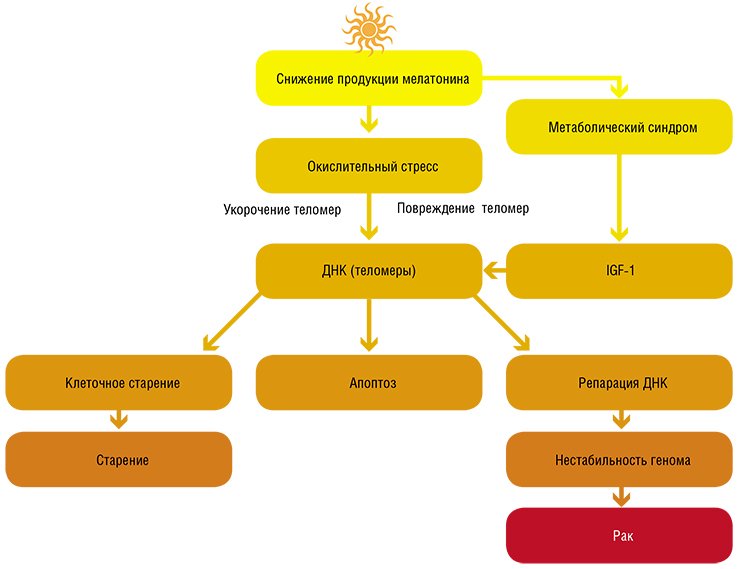
Дополнительное освещение посредством клеточных молекулярных механизмов может ускорять процессы старения и стимулировать образование опухолей
В многочисленных исследованиях показано, что введение мелатонина способно замедлять процессы старения и увеличивать продолжительность жизни лабораторных животных (дрозофил, плоских червей, мышей, крыс). Кроме того, имеются публикации о способности мелатонина повышать устойчивость организма к окислительному стрессу и ослаблять проявления у людей таких заболеваний, как макулодистрофия сетчатки, болезнь Паркинсона, болезнь Альцгеймера, гипертоническая болезнь, сахарный диабет, связанных с преклонным возрастом.
Все перечисленное вызывает определенный оптимизм по поводу возможного использования этого гормона в медицинской практике. Безусловно, необходимы дальнейшие всесторонние клинические испытания мелатонина, которые, как представляется, должны существенно расширить область его применения в лечении и профилактике возрастных заболеваний и, в конечном счете, преждевременного старения.
Литература
1. Анисимов В. Н. Физиологические функции эпифиза (геронтологический аспект) // РФЖ. - 1997. - Т. 83. - № 8. - С. 1-13.
2. Анисимов В. Н. Мелатонин и его место в современной медицине // РМЖ. - 2006. - Т. 14. - № 4. - С. 269-273.
3. Анисимов В. Н., Айламазян Э. К., Батурин Д. А., Забежинский М. А., Алимова И. Н., Попович И. Г., Бениашвили Д. Ш., Мэнтон К. Р., Провинциали М., Франчески К. Световой режим, ановуляция и риск злокачественных новообразований женской репродуктивной системы: механизмы связи и профилактика // Журнал акушерских и женских болезней. - 2003. - Т. 52. - № 2. - С. 47-58.
4. Анисимов В. Н., Виноградова И. А. Световой режим, мелатонин и риск развития рака // Вопросы онкологии. - 2006. - Т. 53. - № 5. - С. 491-498.
5. Анисимов В. Н., Забежинский М. А., Попович И. Г. Мелатонин угнетает канцерогенез толстой кишки, индуцируемый 1,2-диметилгидразином у крыс: эффекты и возможные механизмы // Вопросы онкологии. - 2000. - Т. 46. - № 2. - С. 136-148.
6. Анисимов В. Н., Кветной И. М., Комаров Ф. И., Малиновская Н. К., Рапопорт С. И. Мелатонин в физиологии и патологии желудочно-кишечного тракта. - М., 2000.
7. Арушанян Э. Б. Хронофармакология на рубеже веков. - Ставрополь, 2005.
8. Комаров Ф. И., Рапопорт С. И., Малиновская Н. К., Анисимов В. Н. Мелатонин в норме и патологии. - М., 2004.