КИСЛОРОДНЫЕ КАМЕРЫ В ЭСТЕТИЧЕСКОЙ МЕДИЦИНЕ: МНОГОЕ ВОЗМОЖНО
Дефицит кислорода в тканях (гипоксия) лежит в основе большинства заболеваний, в том числе являясь и причиной ускоренного старения организма. Кислород-зависимыми являются практически все процессы: энергетический обмен, защита от инфекций лейкоцитами, иммунорегуляция, репарация и др. У клиницистов прошлого был популярен афоризм: «Человек молод настолько, насколько молоды его сосуды». Перефразируя высказывание с учетом достижений современной физиологии, можно сказать, что здоровье человека и его молодость определяются, прежде всего, обеспеченностью тканей кислородом, ибо без этого «огонь жизни» гаснет в мозгу через несколько минут, в других органах - через несколько часов. Конечно, эластичность сосудов играет первостепенную роль в доставке кислорода в самые удаленные от легких уголки. Однако с годами сосуды неизбежно теряют эластичность, и врачам приходится искать пути компенсации этой потери.
Первым воплощением мечты врачей о возможности помочь больному с выраженной дыхательной или сердечной недостаточностью и как-то восполнить дефицит кислорода была кислородная подушка, на смену ей пришла кислородная палатка, а затем - барокамера.
Эффект гипер - и нормобарической оксигенации
Оксигенация - это физиотерапевтический метод, основанный на вдыхании воздуха с повышенным содержанием кислорода. Обычный атмосферный воздух содержит 21% кислорода, а используемый в окситерапии, то есть обогащенный кислородом, ― 90,0-99,9%. Для проведения процедуры могут использоваться маска и кислородный баллон или закрытая камера. Различают два типа оксигенации: нормобарическую (при атмосферном давлении) (НБО) и гипербарическую (при давлении выше атмосферного) (ГБО). Иногда выделяют мягкую или умеренную ГБО (mild hyperbaric oxygen therapy), в которой терапия проводится при давлении менее 1,5 атм.
По причине широкого спектра противопоказаний и ограничений (в том числе связанных с противопожарной безопасностью) гипербарическая оксигенация проводится специально подготовленным медперсоналом и исключительно в лечебных учреждениях. В отличие от него, нормобарическая оксигенация - лечебное использование газовых смесей с повышенным содержанием кислорода при нормальном атмосферном давлении. Практически не имеющий противопоказаний, этот метод широко применяется в спа-салонах, салонах красоты и лечебно-оздоровительных центрах.
Источниками кислорода при нормобарической оксигенации могут быть цилиндры с кислородом (их существенный недостаток - пожароопасность), а также концентраторы кислорода - аппараты, которые позволяют получать кислород из атмосферного воздуха. Принцип работы концентраторов основывается на технологии Preserve Absorption (PSA) Technology-NASA и заключается в том, что профильтрованный атмосферный воздух подается на «молекулярное сито» из шариков неорганического силиката (цеолита), где абсорбируются молекулы азота и пропускаются молекулы кислорода. В результате процентное содержание кислорода на выходе из «молекулярного сита» составляет 95%.
Подобные системы находят все более широкое применение благодаря двум основным преимуществам: отсутствию необходимости доставки кислорода от источника и высокой технической надежности аппаратуры. Концентратор кислорода мобилен, несложен и безопасен в эксплуатации.
Экспериментальные и клинические исследования показали, что оксигенация, помимо ликвидации гипоксии, повышает и способности клеток к антиоксидантной защите. Пациенты признаются, что после одного сеанса ГБО они будто "прогулялись в лесу после грозы", а после курса процедур (10-12) - будто вернулись из отпуска ("полны сил и энергии").
У здоровых людей умеренная ГБО существенно повышает адаптационные возможности организма, снижает риск возникновения болезней. Сеансы в барокамере снимают усталость, восстанавливают силы после напряженной работы, повышают мышечный тонус, оказывают антистрессовое, общеукрепляющее и тонизирующее действие, уменьшают последствия неблагоприятного влияния загрязненной атмосферы. Пациенты говорят о повышении работоспособности и стабилизации психоэмоционального состояния [1]. Существенной разницы в терапевтических эффектах НБО и ГБО в большинстве работ не отмечается.
Может показаться, что все предельно просто: недостаток кислорода компенсируется его избытком в воздухе подобно тому, как при дефиците витаминов их употребление исправляет ситуацию. Но с точки зрения физиологии поступление кислорода из легких в ткани осуществляется через кровь, насыщение которой кислородом в норме составляет 97%, и подъем этой цифры до 100% при вдыхании чистого кислорода несущественен. В горах на высоте около 3000 м содержание кислорода в воздухе снижено на 30%, насыщение им крови падает до 90%, и здесь, действительно, по опыту альпинистов и летчиков, вдыхание кислорода оказывает существенный эффект.
В течение года содержание кислорода в воздухе колеблется от максимального в январе (320 г/м3) до минимального в июле (270 г/м3). Поэтому, возможно, в июле нас одолевает лень, состояние расслабленности и желание уйти в отпуск. Многие экологи считают, что сегодня жители мегаполисов страдают от хронической нехватки кислорода. Так, под землей (в метро, в переходах и подземных торговых центрах) концентрация кислорода в воздухе составляет 20,4%, в высотных зданиях - 20,3%, а в битком набитом вагоне наземного транспорта - 20,2%. Физиологи знают, что повышение концентрации кислорода во вдыхаемом воздухе до уровня около 30% благотворно сказывается на здоровье человека и его работоспособности. Не зря космонавты на Международной космической станции дышат воздухом, содержащим 33% кислорода.
Современная наука столкнулась с парадоксом: снижение уровня кислорода в городском воздухе не столь существенно влияет на обеспечение им тканей, но сеансы вдыхания чистого кислорода заметно улучшают здоровье во многих случаях. Конечно, ученые не верят в то, что за несколько сеансов ГБО можно «надышаться» так, что атмосферная гипоксия будет не страшна в течение месяцев. Исследования начинают давать ответы на этот парадокс, и предлагаемые ими ответы мы рассмотрим ниже.
Ускорение заживления ран
Состояние оксигенации тканей является ключевым фактором заживления ран. При возникновении ран обычно ухудшается кровоснабжение в области раневой поверхности, что приводит к локальной гипоксии и нарушению многих процессов, необходимых для заживления. Достаточно назвать основанный на дыхании митохондрий метаболизм клеток, в результате которого происходит синтез белков, деление клеток и их рост, созревание коллагена, синтез окиси азота как регулятора просвета сосудов и процессов формирования новых сосудов. Кроме того, в большом количестве кислорода нуждаются лейкоциты - они синтезируют активные формы кислорода (АФК): супероксид анион-радикал и перекись водорода, которые убивают бактерии и не допускают тем самым заражения ран патогенными микроорганизмами. АФК также выполняют важную функцию сигнализации для различных клеток. Супероксид анион-радикал и перекись водорода стимулируют эндотелиальные клетки к образованию новых сосудов и пролиферации. Кислород необходим и для синтеза нейтрофилами хлорноватистой кислоты (HOCl), мощного дезинфицирующего средства.
Роль оксигенации в заживлении ран детально рассмотрена в одной из работ [2], где приведен рисунок, схематически ее иллюстрирующий (рис. 1).
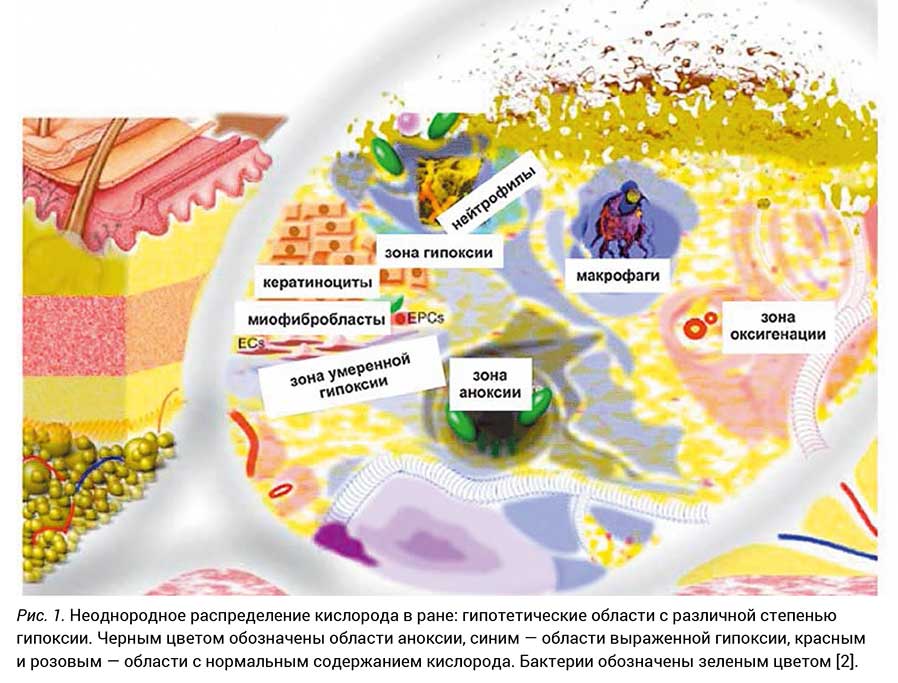
Искусственная оксигенация не только ускоряет заживление ран, но и оказывается весьма эффективной в случае лечения незаживающих ран, например при синдроме диабетической стопы, сопровождающемся язвами разной тяжести. Решающими факторами, которые способствуют развитию незаживающих ран у таких больных, являются уменьшение периферического кровотока и локальное ухудшение ангиогенеза. Процедуры оксигенации эффективно корректируют эти нарушения, что становится ключевым компонентом в лечении хронических ран нижних конечностей и диабетической язвы стопы [3].
Важно понимать, что уровень оксигенации тканей играет не только непосредственную роль в их метаболической и антибактериальной активности, но является стимулом для выхода из костного мозга эндотелиальных прогениторных клеток (ЭПК), которые участвуют в восстановлении эндотелия и формировании новых сосудов. Термины «прогениторная» или «стволовая» клетка, или «клетка-предшественник» относятся к клеткам иммунной системы, которые обладают способностью к самообновлению и дифференцировке в различные типы клеток. Именно поэтому эти клетки могут восстанавливать функции поврежденных тканей.
Мобилизация стволовых клеток при оксигенации
Стволовые клетки, также называемые прогениторными, играют решающую роль в восстановлении поврежденных тканей. Это недифференцированные (незрелые) клетки, имеющиеся во всех многоклеточных организмах. Они способны самообновляться, образуя новые стволовые клетки, делиться посредством митоза и дифференцироваться в специализированные клетки, то есть превращаться в клетки различных органов и тканей. (Интересно отметить, что термин "стволовые клетки" был введен в науку в 1909 г. русским гистологом Александром Максимовым).
Развитие многоклеточных организмов начинается с одной стволовой клетки. В результате многочисленных циклов деления и процесса дифференцировки образуются все виды клеток, характерные для данного биологического вида. В человеческом организме таких видов клеток более 220. Стволовые клетки сохраняются и функционируют и во взрослом организме, благодаря им может осуществляться обновление и восстановление тканей и органов. Тем не менее, в процессе старения организма их количество уменьшается.
Например, в костном мозге новорожденного одна стволовая клетка приходится на 10 тысяч кроветворных, у подростка - на 100 тысяч, у 50-летнего - на 500 тысяч, а у 70-летнего - на миллион. Однако полностью эти клетки не исчезают никогда, а значит, их можно выделить, размножить и активировать. В современной медицине стволовые клетки человека трансплантируют, то есть пересаживают в лечебных целях. Например, трансплантация гемопоэтических стволовых клеток производится для восстановления процесса гемопоэза (кроветворения) при лечении лейкозов и лимфом.
Становится понятным тот огромный интерес, который вызвала в научном мире работа американских ученых [4], обнаруживших, что у 50-летних добровольцев, проходивших сеансы оксигенации, значительно увеличилось содержание в крови стволовых клеток. А именно, уже после одного 2-часового сеанса ГБО (давление 2 атм) количество стволовых клеток, поступивших из костного мозга в кровь, увеличилось втрое. После 10 сеансов ― в 6 раз, а после 20 - в 8 раз.
На основании экспериментов, проведенных с лабораторными животными, исследователи пришли к выводу, что в механизме мобилизации стволовых клеток ключевую роль играет окись азота (NO), которая синтезируется из аминокислоты аргинина ферментом NO-синтазой. Предполагается, что оксигенация активизирует этот фермент и запускает каскад реакций, приводящих к мобилизации стволовых клеток в кровеносное русло, по которому они поступают к поврежденным тканям и осуществляют их заживление путем превращения в специализированные клетки этих тканей. Стивен Тома, профессор Университета Пенсильвании и ведущий автор упомянутого исследования, говорит: «Это самый безопасный для клиники способ, позволяющий увеличить циркуляцию стволовых клеток, и он намного безопаснее, чем любой из фармацевтических вариантов". И добавляет: "Это исследование дает информацию о новом фундаментальном механизме кислородной терапии и предлагает новый вариант терапии для мобилизации стволовых клеток."
Итак, когда мы получаем травму или заболеваем, многие наши клетки повреждаются и даже погибают. Когда это происходит, активируются стволовые клетки. Они обеспечивают восстановление поврежденных тканей, заменяют старые и отмирающие клетки. Таким образом, стволовые клетки поддерживают наше здоровье и предотвращают преждевременное старение. Их можно сравнить с нашей собственной армией микроскопических врачей, и оксигенация является безопасным способом активизации этих микроскопических "врачей" в организме.
Почему именно гипероксия запускает NO-каскад, ведущий к мобилизации стволовых клеток?
Хотя неопровержимые научные факты свидетельствуют о мощном воздействии, которое оказывает вдыхание чистого кислорода на мобилизацию стволовых клеток, остается непонятным, что является пусковым механизмом этого процесса. Ведь насыщенность гемоглобина кислородом, если человек находится на равнине, составляет около 97%, практически независимо от того, каким воздухом мы дышим - с высоким или обычным содержанием кислорода. Единственное место в организме, где при вдыхании чистого кислорода его концентрация возрастает значительно, а точнее почти в 5 раз, является воздух внутри альвеол. Как показали физиологи, в альвеолах есть рецепторы, реагирующие на концентрацию кислорода в воздухе, но главное, при ее повышении в альвеолах происходит активизация одного из видов NO-синтазы [5], а именно индуцированной синтазы оксида азота (NOS II). Основной функцией этого фермента, как предполагают ученые, является иммунная защита от патогенов. Таким образом, в легких присутствуют NO-синтазы, активность которых регулируется концентрацией кислорода во вдыхаемом воздухе.
Какое физиологическое значение может иметь зависимая от уровня кислорода продукция оксида азота? Как известно, оксигенация тканей после значительной ишемии только усугубляет их повреждение, поскольку пострадавшие митохондрии не способны использовать кислород, как это происходит в нормальных тканях. В итоге вновь поступающий кислород оказывается в избытке, вызывая повреждение клеток по типу окислительного стресса (липопероксидации). Как показано в одной из недавно опубликованных работ [6], именно NO способен смягчать такое повреждение.
Оксигенация может препятствовать развитию фиброза
Фиброз (лат. fibrosis) - уплотнение соединительной ткани с появлением рубцовых изменений в различных органах (печени, легких, сердце, кожи и т.д.), возникающее, как правило, в результате хронического воспаления. Развитие фиброза рассматривается как реакция организма, направленная на изоляцию очага воспаления от окружающих тканей и системного кровотока. Фиброзное замещение тканей приводит к постепенной утрате их специфических функций и дисфункции пораженного органа (например, легочная недостаточность при фиброзе легких). Причинами могут быть облучение, травма, инфекционно-аллергические и другие процессы.
Один из механизмов образования фиброза - эпителиально-мезенхимальный переход, при котором эпителиальные клетки приобретают фенотипические свойства мезенхимальных клеток. Мезенхимальные клетки способны активно секретировать компоненты внеклеточного матрикса - коллагены, фибронектин, что может способствовать формированию рубца.
В эстетической медицине с фиброзом связана проблема рубцов. С медицинской точки зрения рубец - следствие заживления повреждения кожи и замещения кожного дефекта соединительной тканью, он представляет собой завершающий этап восстановления кожного покрова. С точки зрения косметолога, рубец - косметический недостаток, который можно и нужно устранить или хотя бы уменьшить. Среди причин образования рубцов выделяют травмы (шрамы после порезов, рваных и колотых раны, ожогов, хирургических операций) и последствия заболеваний кожи (угревой сыпи, фурункулов, флегмон, оспы и др.).
Можно ли предотвратить развитие фиброза, используя оксигенацию, которая вызывает мобилизацию стволовых клеток? На этот вопрос попытались ответить исследователи в опубликованной в 2014 г. работе [7], где на экспериментальных животных моделировали развитие фиброза подчелюстных слюнных желез после воздействия радиации (15 Gy). В клинической практике развитие фиброза слюнных желез встречается после радиотерапии опухолей головы и шеи.
Сеансы оксигенации животным проводили 5 раз в неделю на протяжении 2 недель по 30 минут при давлении 2,2 атм, в отдельных случаях максимальное число сеансов составляло 20. Результаты экспериментов показали, что сеансы ГБО полностью подавляли развитие фиброза у облученных животных. Авторы связывают это с подавлением активации цитокина TGFβ (трансформирующий ростовой фактор бета (англ. Transforming growth factor beta) - белка, который контролирует пролиферацию, клеточную дифференцировку и другие функции в большинстве клеток. Активация продукции этого цитокина имеет ключевое значение для развития фиброза. TGF-beta действует как антипролиферативный фактор в нормальных эпителиальных клетках и на ранних стадиях онкогенеза.
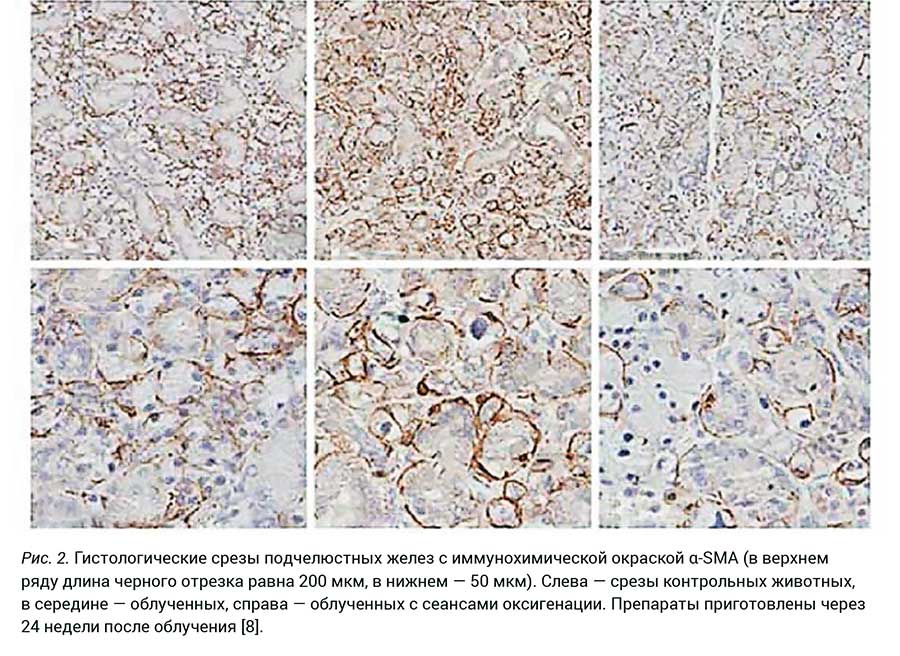
В качестве удобного маркера фиброза авторы использовали иммунохимическое выявление на гистологических срезах изоформы актина α-SMA (Alpha-Smooth Muscle Actin ― альфа-гладкомышечный актин). Этот белок играет определяющую роль в развитии фиброза [8]. На рис. 2 представлены срезы подчелюстной железы с иммунохимической окраской α-SMA (коричневый цвет) у контрольных животных (слева), облученных (в середине) и облученных с последующим проведением сеансов ГБО. Препараты приготовлены через 24 недели после облучения. Как видно из представленных микрофотографий, α-SMA выявляется в значительно большей степени у облученных животных. У животных, получавших сеансы оксигенации, наличие α-SMA практически такое же, как в контрольной группе, что убедительно доказывает подавление развития фиброза при проведении окситерапии.
Таким образом, сеансы оксигенации, по-видимому, оказывают благотворное воздействие на организм благодаря чувствительности рецепторов альвеол к содержанию кислорода в альвеолярном воздухе и продукции альвеолярных клеток оксида азота в кровеносное русло.
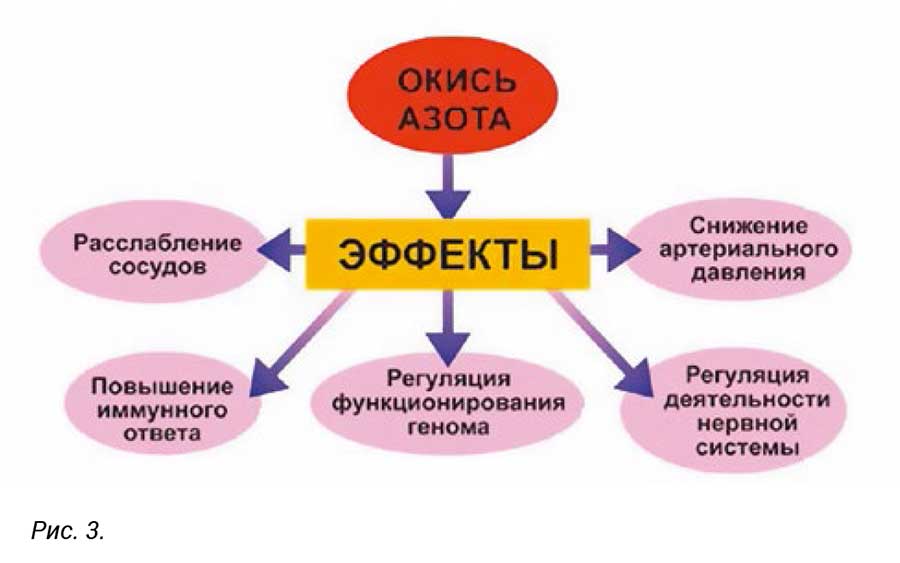
В конце 20-го века оксид азота стал новой "путеводной звездой" в медицине, указывающей направление поиска лекарственных средств против множества болезней. За разработку проблемы окиси азота в биологии и медицине ряд ученых удостоен Нобелевской премии по физиологии и медицине 1998 года. Точная формулировка звучит так: "Нобелевская премия по физиологии и медицине присуждена за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе". Нобелевскими лауреатами стали американские ученые Роберт Форшготт, Ферид Мьюрэд и Луис Игнарро. Оказалось, что окись азота управляет как внутриклеточными, так и межклеточными процессами в живой клетке. Многие болезни - гипертония, ишемия миокарда, тромбозы, рак - вызваны нарушением физиологических процессов, которые регулирует окись азота. Именно по этой причине она представляет огромный интерес для биологов и медиков самых разных специальностей. Схематично основные эффекты, обусловленные повышением концентрации NO, показаны на рис. 3 [9].
 Возможно, большинство целебных эффектов оксигенации в кислородных камерах связано именно с активацией индуцибельной NO-синтазы легких. А долговременные эффекты улучшения здоровья, видимо, обусловлены мобилизацией стволовых клеток, увеличением их концентрации в крови и ускорением репаративных процессов в тех зонах организма, где происходит обновление тканей. Важно отметить, что стволовые клетки сами способны находить такие зоны и осуществлять процессы репарации.
Возможно, большинство целебных эффектов оксигенации в кислородных камерах связано именно с активацией индуцибельной NO-синтазы легких. А долговременные эффекты улучшения здоровья, видимо, обусловлены мобилизацией стволовых клеток, увеличением их концентрации в крови и ускорением репаративных процессов в тех зонах организма, где происходит обновление тканей. Важно отметить, что стволовые клетки сами способны находить такие зоны и осуществлять процессы репарации.
Итак, слова знаменитой песни о том, что можно «стать моложе, если ветра веселого хлебнуть», вполне подтверждаются современной наукой. Правда, сегодня удобнее делать это в специальных кислородных камерах.
Как отмечают врачи, использующие кислородные камеры, сразу после сеанса баротерапии у пациента восстанавливается энергетика организма, проходит усталость, повышается тонус мышц. Ускоряется заживление травм связок и мышц, которым часто подвержены спортсмены, быстрее и легче обретается оптимальная форма, увеличивается ресурс выносливости. Всего этого можно добиться, принимая лишь одно «лекарство», ― молекулы кислорода в максимальной концентрации.
Литература
1. Деев А.И., Шарова А.А., Брагина И.Ю. Новая косметология. Аппаратная косметология и физиотерапия. Под общей ред. Е.И. Эрнандес. Издательский дом «Косметика и медицина», М, 2014, с. 367-372.
2. Sen CK. Wound healing essentials: let there be oxygen. Wound Repair Regen. 2009 Jan-Feb;17(1):1-18.
3. Liu ZJ, Velazquez OC. Hyperoxia, endothelial progenitor cell mobilization, and diabetic wound healing. Antioxid Redox Signal. 2008 Nov;10(11):1869-82.
4. Thom SR, Bhopale VM, Velazquez OC, Goldstein LJ, Thom LH, Buerk DG. Stem cell mobilization by hyperbaric oxygen. Am J Physiol Heart Circ Physiol. 2006 Apr;290(4):H1378-86.
5. Dweik RA, Laskowski D, Abu-Soud HM, Kaneko F, Hutte R, Stuehr DJ, Erzurum SC. Nitric oxide synthesis in the lung. Regulation by oxygen through a kinetic mechanism. J Clin Invest. 1998 Feb 1;101(3):660-6.
6. Baynosa RC, Naig AL, Murphy PS, Fang XH, Stephenson LL, Khiabani KT, Wang WZ, Zamboni WA. The effect of hyperbaric oxygen on nitric oxide synthase activity and expression in ischemia-reperfusion injury. J Surg Res. 2013 Jul;183(1):355-61.
7. Spiegelberg L, Swagemakers SM, Van Ijcken WF, Oole E, Wolvius EB, Essers J, Braks JA. Gene Expression Analysis Reveals Inhibition of Radiation-Induced TGFβ-Signaling by Hyperbaric Oxygen Therapy in Mouse Salivary Glands. Mol Med. 2014 Jul 10;20(1):257-69.
8. Shen Cherng, Jenny Young, Hongbao M. Alpha-Smooth Muscle Actin (α-SMA). The Journal of American Science, 2008, 4(4), 7-9.
9. Петренко Ю. Окись азота и судьба человека. Наука и жизнь, 2001, №7, 40-43.