Источники и пути образования оксида азота в организме
Введение
Современные представления о регуляции клеточных процессов позволяют особо выделить некоторые химические соединения, обладающие полифункциональным физиологическим действием. К числу таких соединений с полным основанием можно отнести оксид азота. Данный свободный радикал способен оказывать как активирующее, так и ингибирующее действие на различные метаболические процессы, протекающие в организме млекопитающих и человека. Несмотря на многочисленные исследования, значение оксида азота в системной регуляции гомеостаза клеток и тканей не вполне понятно.
Оксид азота (NO) - газ, хорошо известный химикам и физикам, в последнее время привлек пристальное внимание биологов и медиков. Интенсивное изучение биологического влияния NO началось с 80-х годов, когда Р. Фуршготт и Дж. Завадски показали, что расширение кровеносных сосудов под влиянием ацетилхолина происходит только при наличии эндотелия - эпителиоподобных клеток, выстилающих внутреннюю поверхность всех сосудов. Вещество, выделяющееся эндотелиальными клетками в ответ не только на ацетилхолин, но и на многие другие внешние воздействия, приводящие к расширению сосудов, получило название «сосудорасширяющий эндотелиальный фактор». Несколько позже было доказано, что это вещество является газом NO и в клетках имеются особые ферментные системы, способные его синтезировать.
В настоящей работе предпринята попытка проанализировать известные на сегодняшний день данные и представить по возможности полную картину физиологической и метаболической роли данного медиатора.
По своей химической структуре оксид азота относится к нейтральным двухатомным молекулам. Благодаря наличию неспаренного электрона на внешней π-орбитали молекула NO обладает высокой реакционной способностью и свойствами свободного радикала.
Синтез оксида азота
В организме человека и млекопитающих оксид азота главным образом образуется в результате окисления гуанидиновой группы аминокислоты L-аргинина с одновременным синтезом другой аминокислоты цитруллина под влиянием фермента NO-синтазы. Фермент был назван синтазой, а не синтетазой, поскольку для его работы не требуется энергия АТФ (см. [2] в списке литературы).
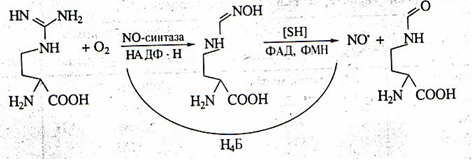
Рис. 1. Схема синтеза окиси азота из L-аргинина
Кроме L-аргинина NOS может использовать в качестве субстратов гомоаргинин, аргиниласпарагин, метиловый эфир аргинина, гуанидинотиолы. При недостатке субстрата в клетках или Н4Б фермент начинает восстанавливать кислород до супероксид радикала и перекиси водорода. Такие условия могут быть следствием как нарушения транспорта аминокислоты (в некоторых тканях она не синтезируется), так и недостатка в пище, поскольку синтез L-аргинина при этом в организме не увеличивается [1].
Структура NO-синтазы. Основные типы фермента
NO-синтаза - это сложно устроенный фермент, представляющий собой гомодимер. То есть он состоит из двух одинаковых белковых субъединиц, к каждой из которых присоединено несколько кофакторов, определяющих каталитические свойства фермента. Активность фермента проявляется только при объединении двух его субъединиц [2].
Фермент является димером, состоящим из двух одинаковых белковых молекул, каждая из которых связана с необходимыми для работы фермента кофакторами: НАДФ, ФАД, ФМН, гемовая группа, содержащая железо, кальмодулин, и тетрагидробиоптерин (ВН4). Связь между белковыми субъединицами происходит в области их N0конца, где с ними связаны гемовые группы. Стрелками показан перенос электронов [2].
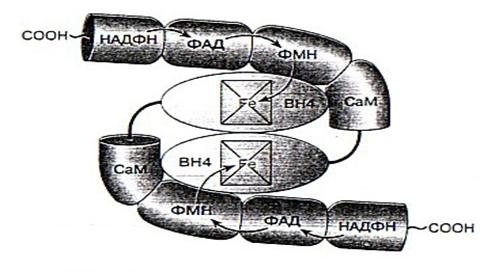
Рис. 2. Схематичное представление строения NO-синтазы.
NO-синтазы составляют семейство, то есть имеется группа ферментов, несколько различающихся по аминокислотной последовательности белковой части молекулы и механизмам, регулирующим их активность, но тем не менее, катализирующих одну и ту же реакцию превращения аминокислот с образованием оксида азота. В настоящее время хорошо изучена структура разных изоформ NO-синтазы (NOS), известны механизмы, регулирующие их активность, и хромосомная локализация генов, ответственных за синтез ферментов, проведено клонирование (получение большого числа копий) этих генов, получены генетические модификации мышей без генов разных изоформ фермента (так называемые нокаут мыши) [2].
Синтезировать и выделять NO способны большинство клеток организма человека и животных, однако наиболее изучены три клеточные популяции: эндотелий кровеносных сосудов, клетки нервной ткани (нейроны) и макрофаги - клетки соединительной ткани, обладающие высокой фагоцитарной активностью. В связи с этим традиционно выделяют три основные изоформы NO-синтаз (NOS): нейрональную, макрофагальную и эндотелиальную (обозначаются соответственно как NO-синтаза I, II и III). Нейрональная и эндотелиальная изоформы фермента постоянно присутствуют в клетках и называются конститутивными, а вторая изоформа (макрофагальная) является индуцибельной - фермент синтезируется в ответ на определенное внешнее воздействие на клетку [2].
Молекулы всех изоформ фермента NOS содержат N-терминальный оксигеназный домен и С-терминальный домен редуктазы. Домен оксигеназы с примерно 500 аминокислотными остатками включает участки для связывания гемовой группы, кофактора Н4В и субстрата L-аргинина. Домен с редуктазной активностью, состоящий из 570-625 аминокислотных остатков, участвует в связывании молекул ФАД, ФМН и НАДФ*Н. между этими доменами расположена последовательность из 30 аминокислотных остатков для связывания белка кальмодулина (СаМ) - переносчика электронов с флавина на железо гемовой группы оксигеназы [3].
Каждый изофермент имеет специфическую N-терминальную лидирующую последовательность аминокислотных остатков, не участвующую в катализе и, вероятно, определяющую внутриклеточную локализацию фермента. Так, N-терминальная последовательность эндотелиального фермента включает три участка ацилирования жирными кислотами, которые играют важную роль в процессе связывания с мембраной. Нейрональная NOS содержит в N-концевом домене PDZ-фрагмент из 100 аминокислотных остатков. Это фрагмент, участвуя в процессе узнавания белка, определяют субклеточную локализацию молекул NOS[3].
Все три типа NOS в своей активной форме - гомодимеры. В образовании димера принимает участие оксигеназный домен NOS. Процесс димеризации инициируется присоединением к субъединицам гемовых простетических групп. Последующее присоединение Н4В стабилизирует образовавшийся димер NOS. Без гемовой группы NOS является мономером, не проявляющим NO-синтазной активности. При этом мономерная форма NOS обладает полной цитохром-с-редуктазной активностью и способностью связывать ФАД и ФМН [3].
Последовательность редуктазного домена на 50% гомологична другим ФМН и ФАД-содержащим редуктазам (например, цитохром Р-450 редуктаза), что свидетельствует о сохранении основных признаков этого класса ферментов для редуктазы NOS. Так, экспрессируясь отдельно или как часть холофермента, домен редуктазы может непосредственно переносить электроны с НАДФ*Н на оксигеназный домен и другие акцепторы, такие как цитохром с и феррицианид. Редуктаза NOS стабилизируется одноэлектронным восстановлением флавина и может принимать, по крайней мере, 3 электрона с НАДФ*Н [3].
Одним из самых важных кофакторов является внутриклеточный кальцийсвязывающий белок кальмодули. При повышении содержания ионов кальция в клетке он присоединяется к молекуле NO-синтазы, что приводит к активации фермента и синтезу NO (слайд 2). Такое свойство фермента имеет большое значение для клеток, поскольку ферментативная активность, а значит, и синтез NO прямо зависят от функционального состояния клетки, определяющегося во многом внутриклеточным уровнем ионов кальция - высокоактивных посредников, влияющих на многие процессы в клетках. Среди других регуляторных механизмов фермента следует отметить возможность фосфорилирования белковой части молекулы и влияние особых белков, участвующих в связывании двух субъединиц фермента в единый функционально активный комплекс [2].
Активность конститутивных (т.е. нейрональная и эндотелиальная) изоформ фермента прямо зависит от внутриклеточной концентрации ионов кальция или кальмодулина и, таким образом, повышается под влиянием различных агентов, приводящих к увеличению их уровня в клетке. Конститутивные изоформы NO-синтазы имеют преимущественно физиологическое значение, поскольку количество образуемого NO относительно невелико [2].
Индуцибельные (т.е. макрофагальные) изоформы NO-синтазы проявляют активность через некоторое время (как правило, 6-8ч - время, необходимое для активации генов и начала синтеза фермента) после внешнего воздействия на клетки, продуцируют огромные (в 100-1000 раз больше, чем конститутивные изоформы фермента) количества NO. Поскольку высокие дозы NO токсичны для клеток, эта форма фермента считается патологической в отличие от конститутивной. Активность индуцибельной NO-синтазы не зависит от уровня кальция/кальмодулина, поскольку, как полагают, кальмодулин постоянно и прочно связан с ферментом [2].
Локализация NO-синтазы
В настоящее время показано, что не только макрофаги, но и многие другие клетки (нейтрофилы, гепатоциты, гладкомышечные клетки, клетки астроглии) способны при определенных внешних воздействиях, в основном в условиях патологии, синтезировать индуцибельную изоформу NO-синтазы. Нейрональная NOS обнаружена не только в нервных клетках, но и в скелетных мышцах. Эндотелиальная NOS обнаружена в эндотелиальных клетках, клетках эпителия и кардиомиоцитах. Нейрональная и макрофагальная формы фермента находятся в клетках преимущественно в растворенном состоянии - в цитозоле, а эндотелиальная NO-синтаза обычно связана с клеточными мембранами [2].
N-концевая последовательность NOS подвергается миристоилированию и пальмитоилированию, что определяет ее субклеточную локализацию и косвенно ее активность. Так, для фиксации эндотелиальной NOS в плазматической мембране необходимо ацилирование N-терминальных остатков глицина в молекулах фермента с образованием амидных связей [3].
Нейрональная изоформа NOS связана с мембраной за счет взаимодействия N-концевого PDZ-фрагмента с белками типа PSD-95, PSD-93 и дистрофинсвязанным белком - синтрофином [3].
В отличие от конститутивных изоформ, индуцибельная NOS, не связанная с мембранными белками, является цитозольным ферментом [3]. Однако сравнительно недавно в митохондриях была выявлена конститутивно экспрессируемая NO-синтаза. По основным характеристикам митохондриальная NOS сходна с макрофагальной [16]. Сравнивая скорости продукции NO интактными митохондриями, митохондриальным гомогенатом и субмитохондриальными частицами (1.4, 4.9 и 7.1 нмоль/мин на мг белка соответственно) можно сделать вывод, что mtNOS фиксирована на внутренней мембране митохондрий, тогда как iNOS является цитозольным ферментом. Вопрос о том, что представляет собой митохондриальная NOS - отдельную изоформу фермента или же модифицированную во время трансляции или после нее индуцибельную NOS (как это имеет место в скелетных мышцах для нейрональной) - остается открытым [3].
Таблица 1. Физико-химические характеристики NO-синтаз человека[1].
| Характеристика | Изоформа NO-синтазы | ||
| Нейрональная | Индуцируемая | Эндотелиальная | |
|
Источник выделения белка Молекулярная масса Нативная структура Аминокислотная длина Локализация в клетке Локализация в геноме |
Нейроны мозга 160кДа Димер 1433 Цитозоль Хромосома 12 |
Макрофаги 130кДа Димер 1153 Цитозоль Хромосома 17 |
Эндотелий сосудов 133 кДа Нет данных 1203 Мембрана, цитозоль Хромосома 7 |
Регуляция активности NOS
В процессе образования NO флавин редуктазы принимает электроны с НАДФ*Н и переносит их на железо гемовой группы. В результате этой реакции образуется активированная молекула О2, необходимая для синтеза NO. В эндотелиальной NOS и нейрональной NOS перенос электронов с флавина на гемм инициируется связыванием СаМ соответствующим сайтом фермента., т.е. СаМ участвует в регуляции продукции NO этими конститутивными NOS [3].
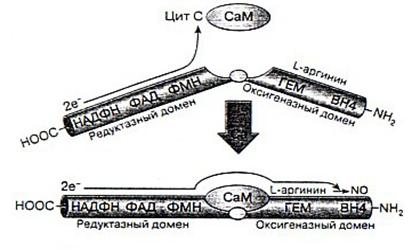
Рис.3. Схематическое представление синтеза NO и регуляции работы NO-синтазы[2].
Считается, что механизм активирующего действия СаМ на нейрональную NOS обусловлен изменением конформации редуктазного домена при связывании этого белка, что, в свою очередь, приводит к повышению скорости переноса электронов как на флавины, так и на конечные акцепторы электронов. Показано, что при этом СаМ активирует выраженные, происходят и при связывании СаМ эндотелиальной формой NOS. В отличие от нейрональной и эндотелиальной NOS, индуцибельная связывает редуктазный домен независимо от домена оксигеназы. Такие же изменения, но менее СаМ практически необратимо, что проявляется длительной продукцией NO этим ферментом [3].
Таким образом, нейрональная и эндотелиальная NOS неактивны при нормальном уровне Са2+ в клетке и начинают синтезировать NO в ответ на увеличение концентрации кальция в цитозоле, вызывающее связывание СаМ этими конститутивными ферментами. Длительное повышение уровня кальция приводит к постоянной продукции NO. Напротив, продукция индуцибельной формой NOS не зависит от уровня внутриклеточного кальция и при нормальном его уровне лимитирована только количеством фермента и субстрата и наличием кофакторов [3].
Один из механизмов регуляции продукции NO - фосфорилирование молекулы NO-синтазы. Фосфорилирование конститутивных NOS цАМФ-зависмой протеинкиназой, протеинкиназой С, цГМФ-зависимой протеинкиназой, Са2+-кальмодулинзависимой протеинкиназой ведет к снижению активности этих ферментов. С другой стороны, протеинфосфатаза-кальцийнейрин может дефосфорилировать NOS, вызывая тем самым повышение ее каталитической активности [3].
Кроме того, для NO-синтаз характерна регуляция по механизму отрицательной обратной связи. При этом к действию оксида азота, выступающего в качестве неконкурентного ингибитора, более чувствительны конститутивные изоформы, снижение активности, которых происходит за счет связывания NO с атомом железа гемовой группы ферментов [11]. Ингибирующее действие NO на индуцибельную NOS, возможно, связано с ограничением димеризации молекулы фермента [3].
Считается, что NO может осуществлять ретроградную регуляцию не только путем взаимодействия с гемом фермента, но и через ингибирование транскрипции мРНК NO-синтазы (либо непосредственно, либо за счет угнетения активации фактора транскрипции NF-kB) [3] .
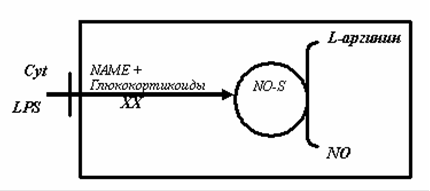
Рис.4. Стимуляция и ингибиция индуцибельной NO-синтазы [8].
Активация рецепторов гепатоцитов, клеток моноцитарно-макрофагальной системы и некоторых клеток крови цитокинами (Cyt) и липосахаридами (LPS), под влиянием которых происходит индукция индуцибельной синтазы окиси азота, синтезирующей NO из L-аргинина. Блокада (ХХ) i-NOS глюкокортикоидами или другими блокаторами ее активности. Образовавшийся NO диффундирует в межклеточное пространство [8],[9].
Таблица 2. Синтетические и природные агенты, модулирующие активность NO-синтаз [1].
| Типы модулятора | Изоформа фермента | ||
| Noc-I | Noc-II | Noc-III | |
|
Активаторы/индукторы Ингибиторы |
Глутамат, N-метил-D-аспартат L-тиоцитруллин, 7-нитроиндазол, нитроаргинин |
Цис-платина, интерлейкин 1-β, интерферон-γ, липополисахарид, фактор некроза опухоли -α и -β, γ-излучение N-(3-(аминометил)-бензил)-ацетамидин, N6-(1-иминоэтил)-бензил)-ацетамидин; аминогуанидин, дексаметазон, ингибиторы сериновых протеаз, интерлейкин-4 и -10; L-NMMA; простагландин Е2, простациклин; N6-(1-иминоэтил)-L-лизин; 3-гидроксиантраниловая кислота; метотрексат |
Субстанция Р, АДФ, сдвиговое напряжение и пульсации давления крови, тромбин, гипомагнеземия, гистамин, Са2+-ионофоры, лейкотриены, олеиновая кислота, фактор активации тромбоцитов, аденозин, АТФ, ацетилхлин, брадикинин, серотонин; хлористый калий, эндотелин. Нитроимидоорнитин; иминоэтилорнитин, L-НАМЭ; АДМА |
Неферментативное образование оксида азота
Для биологических тканей помимо генерации оксида азота в ходе ферментативных реакций с участием NOS обнаружена возможность превращения нитрит-аниона в NO [7]. Этот процесс происходит в условиях ацидоза и при наличии восстановленных форм гемсодеращих белков, что характерно для такого патологического состояния как ишемия [3].
Так, образование оксида азота из нитрита может происходить в соответствии со следующей последовательностью реакций:
![]() NO-2 + H + HNO2
NO-2 + H + HNO2
![]() HNO2 {NOOH}
HNO2 {NOOH}
![]() {NOOH} + NO-2 N2O3 + OH-
{NOOH} + NO-2 N2O3 + OH-
![]() N2O3 NO + NO2
N2O3 NO + NO2
Кроме того, ионы NO-2 способны восстанавливаться до оксида азота в ходе окислительно-восстановительных реакций, акцептируя электроны с дезокси-форм гемсодержащих белков. Так, при взаимодействии NO с восстановленным гемоглобином происходит окисление Hb2+ до metHb и восстановление ионов NO-2 до NO:
![]() Hb2+ + NO-2 + 2H + metHb + NO + H2O
Hb2+ + NO-2 + 2H + metHb + NO + H2O
Нитритредуктазная активность также показана для миоглобина, цитохром-с-оксидазы и цитохрома Р-450.
Факт образования NO в биологических тканях из нитрит-аниона позволил предположить возможность существования механизма циклического превращения оксида азота в организме:
![]()
![]()
![]() L-Arg NO NO-2/NO-3 NO
L-Arg NO NO-2/NO-3 NO
Данное положение нашло отражение в концепции цикла оксида азота в организме млекопитающих. При этом NO-синтазная компонента обеспечивает эндогенный синтез NO, NO-2, NO-3 в присутствии кислорода. В условиях гипоксии или функциональной нагрузки, при которой осуществляется активное потребление кислорода, NO-синтазный механизм ингибируется [10].
В то же время дефицит кислорода приводит к активации нитритредуктазной компоненты цикла. Считается, что циклизация метаболических путей обеспечивает высокую степень упорядоченности и связанности систем биохимических реакций. Таким образом, механизм циклических превращений для NO и других высокореакционных азотсодержащих соединений гарантирует не только их эффективную переработку, но и достаточно быстрое выведение путем превращения в менее активные вещества, например ионы NO-2 и NO-3[3].
Методы определения оксида азота
Описанные в литературе методы определения NO можно условно разделить на прямые (таблица 2) и косвенные (таблица 3). В число первых входят те, с помощью которых осуществляется непосредственная регистрация NO, либо его комплексов. Прежде всего, это метод электронного парамагнитного резонанса (ЭПР) как средство изучения молекул с неспаренным электроном. Предложено использовать в качестве индикаторов NO регистрируемые методом ЭПР нитрозильные железосодержащие комплексы, устойчивые в биологически активных средах [1].
В живой ткани SH-содержащие белки, пептиды и аминокислоты образуют такие парамагнитные аддукты общего состава Fe(NO)2(SR)2, спектры ЭПР которых являются ассиметричными вариацией g-фактора от 2.01 до 2.05. однако из-за большого разнообразия естественных акцепторов NO и вариабельности их содержания, количественное определение этого радикала таким образом вряд ли возможно. В то же время гемопротеиды (гемоглобин, миоглобин, цитохром а3 и др.) образуют нитрозильные парамагнитные комплексы, имеющие широкий спектр ЭПР [1].
С разрешенной сверхтонкой структурой (СТС) в области значений g-фактора меньше 2. Анализ полученных спектров ЭПР свидетельствует о том, что структура указанных комплексов имеет ромбическую симметрию [13].
Таблица 3. прямые методы регистрации оксида азота[1].
| Инструментальный метод | Соединение-индикатор/реакция-индикатор | Чувствительность |
| ЭПР | Fe-(NO)2-(SR)2 | |
| ЭПР | Hb-Fe(II)-NO | 5 мкМ |
| ЭПР | (ДТК)2-Fe(II)-NO | 1 мкМ |
| ЭПР, L-линия | Фьюзинит-NO | 1 мкМ |
| Хемилюминесценция | NO + O3 = hν + NOx | 20 нМ |
| Амперовольтметрия | NO + e = NOx | 10 нМ |
Более перспективным представляется метод с использованием карбоксигемоглобина в качестве экзогенной спиновой ловушки оксида азота. На состояние Hb-Fe(II)-CO не оказывает влияния степень оксигенации среды, а поскольку прочность связывания NO с гемоглобином на три порядка больше, чем прочность связывания СО, то можно ожидать практически количественного образования нитрозил-гемоглобина. Следует, однако, отметить, что гемоглобин или его производные имеют ряд особенностей, ограничивающих применение их в качестве естественной или экзогенной спиновой ловушки. Проникновение крупных молекул в клетки к месту синтеза оксида азота крайне затруднено, поэтому включаться в комплекс и становиться ЭПР-видимой будет лишь часть оксида азота, не метаболизированная в период диффузии. Кроме того, недостаточно определены пути и скорости дальнейших превращений Hb-Fe(II)-NO в живой клетке [1].
При прямом определении NO методом ЭПР-спектрометрии перспективным представляется использование в качестве спиновой ловушки производных дитиокарбаминовой кислоты (ДТК). В организме они образуют ЭПР-видимые комплексы состава (ДТК)2-Fe-NO, включающие в себя «свободное» железо [14]. Эти комплексообразователи позволяют изучать образование оксида азота в тканях животных, в гомогенах, в культуре клеток и биологических жидкостях. Важно, что при оптимальных нетоксичных концентрациях ДТК их высокая скорость взаимодействия с NO существенно снижает вероятность реакции оксида азота с другими биомолекулами, в том числе с радикалами, и тем самым ограничивает влияние этих реакций на результаты ЭПР-спектрометрии [1].
Предложен оригинальный метод ЭПР-дозиметрии NO, в котором применена спиновая макроловушка - фьюзиниты. Это частицы размером 10 мкм, выделяемые из угля. Они обладают способность поглощать оксид азота с изменением характеристик собственного ЭПР-спектра. Не подвергаясь метаболизму, они не оказывают токсического действия на клетки, и после поглощения путем фагоцитоза могут быть использованы в качестве аналитического средства, специфического к оксиду азота [1].
Наиболее чувствительным среди методов определения NO в организме или в клеточных системах является электрохимический метод. Он основан на каталитическом окислении оксида азота полимерным металлопорфирином (полупроводником n-типа), которое протекает при 630 мВ. Диаметр электрода может достигать 0,2 мкм, что позволяет измерять внутриклеточное производство оксида азота. Поскольку время ответа электрода составляет около 10 мс, часть радикалов, вступающая в очень быстрые реакции (например, с супероксид-радикалом), не может быть зарегистрирована [15]. С помощью этого методы были проведены измерения содержания оксида азота в крови человека [1].
Хемилюминесцентный метод основан на регистрации фотонов, излучаемых в реакции NO с озоном. Несмотря на высокую чувствительность, применение его к биологическим объектам затрудняется сложным этапом доставки радикала в анаэробную газовую фазу. Кроме того, на выход люминесценции оказывают влияние аммиак, олефины, окислы серы и другие продукты, выделяющиеся в результате биологической активности организма и часто содержащиеся в стенках аппаратуры [1].
Среди непрямых методов определения NO (таблица 3) наиболее распространенным методом оценки его синтеза является реакция на нитрит-анион с использованием реагента Грисса (раствор сульфаниламида и N-(1-нафтил) -этилендиамида в 2,5%-ной ортофосфорной кислоте), которая дает окрашенный дазопродукт с максимумом поглощения при 548 нм. Обычно отношение содержания NO-2/NO-3 у млекопитающих составляет 1 : 10. и хотя содержание нитрит-аниона менее подвержено влиянию состава питания, при необходимости более полного определения продукции оксида азота измеряют и содержание нитрат-аниона. Для этого NO-3, выделяющийся в культурную среду или биологические жидкости, восстанавливают металлическим кадмием, импрегнированным медью, или ферментативно, нитратредуктазой [1].
Таблица 4. косвенные методы определения оксида азота [1].
| Соединение-индикатор | Принцип определения | Метод регистрации, чувствительность |
| Метгемоглобин | Hb-Fe(II)-O2 + NO = =Hb-Fe(III) + NO-2 | Фотометрия, 2 нм |
| Иминонитроксид (ИН) | Нитронил нитроксид+NO = =ИН | ЭПР |
| Нитрит-анион | NO-2 + реагент Грисса = диазопродукт | Фотометрия, 1 мкм |
| Нитрит-анион | ФТИО* + NO = NO-2 | То же |
| Нитрат-анион |
NO-3 + Cd = NO-2 NO-3 + нитратредуктаза = =NO-2 |
То же |
| Нитрит-анион | NO-2 + S2O-4 = NO+Hb-Fe(II) = Hb-Fe(II)-NO | ЭПР, 1 мкм |
| Цитруллин | 3H-L-аргинин + NOc = 3H-L-цитруллин | ВРЖХ, радиометрия; 0,1 мкм |
| цГМФ | NO + 3Н-ГМФ + ГЦ = =3Н-цГМФ | Хроматграфия, радиометрия |
| бис-Формазан (БФ) | ТНС* + NOc + НАДФ.Н = =БФ | Гистохимия |
| НАДФ.Н | НАДФ.Н + L-аргинин + NOc = НАДФ.Н | Флуорометрия |
* ФТИО - 2-(4-карбокифенил)-4,4,5,5-тетраметилимидазолин-3-оксид-1-оксил;
ТНС - тетразолий нитросиний;
ГЦ - гуанилатциклаза.
Высокую чувствительность имеет метод, основанный на фотометрии метгемоглобина, образующегося в результате окисления оксигемоглобина NO. Применения двухволновой спектрофотомерии дает возможность определять до 2 нМ оксида азота [9]. В качестве субстратов также могут быть использованы дезокси- и карбоксигемоглобин. Серьезным недостатком, ограничивающим применение этих методик, является необходимость очистки исследуемых объектов от эндогенного гемоглобина, а также соединений, способных его окислять[1].
Как известно, оксид азота образуется из L-аргинина в эквимолярном отношении с L-цитруллином. На этом основан радиометрический метод определения NO по появлению L-цитруллина, меченного радиоактивной меткой, происходящей из L-аргинина. В определенных условиях для оценки синтеза цитруллина может быть полезной колориметрическая реакция на карбаминогруппу. Другой необходимый компонент синтеза NO - НАДФ.Н. разница в скорости его окисления в присутствии и в отсутствии ингибитора NO-синтазы может служить показателем синтеза NO. Подобный метод применяется в гистохимии, где регистрируется НАДФ.Н-зависимая диафоразная активность NO-синтазы в присутствии и в отсутствии ее ингибиторов [1].
В качестве показателя синтеза NO в клеточных экстрактах также используется универсальная способность этого радикала увеличивать активность гуанилатциклазы в 10-50 раз. Ряд методов основан на измерениях физиологических реакций, инициируемых NO, таких как релаксация сосудов, ингибирование адгезии тромбоцитов и др. [1].
Некоторые производные NO также проявляют NO-подобную физиологическую активность, поэтому помимо биотестов были предложены инструментальные методы их определения (хемилюминесценция с предварительным фотолизом образцов) [1].
Участие оксида азота в биохимических процессах
Механизм действия NO
Низкомолекулярный газ NO легко проникает через клеточные мембраны и компоненты межклеточного вещества, однако время его полужизни (в среднем не более 5с) и расстояние возможной диффузии (небольшое, в среднем 30 мкм) ограничиваются высокой реакционной способностью молекулы и ее взаимодействием со многими возможными субстратами [2].
Действие, оказываемое NO на клетки, во многом зависит от количества газа. В небольших количествах, продуцирующихся обычно конститутивными формами NO-синтазы, эффект NO в основном связан с влиянием на гемовую группу растворимой (цитозольной) формы гуанилатциклазы. Активированный фермент синтезирует циклический гуанозин монофосфат (цГМФ) - активный внутриклеточный посредник, регулирующий работу мембранных ионных каналов, процессы фосфорилирования белков (через протеинкиназы), активность фосфодиэстеразы, а также др. реакции [2].
В больших концентрациях, образующихся, как правило, индуцибельной изоформой NO-синтазы, NO может оказывать на клетки токсический эффект, связанный как с прямым действием на железосодержащие ферменты, так и с образованием сильного окислителя, очень реакционного и токсичного свободнорадикального соединения пероксинитрита [14]. Пероксинитрит (ONOO-) образуется при взаимодействии NO с радикальным супероксид анионом(О2-):
NO + O2- = ONOO- [2]
Участие NO в защитных иммунологических реакциях
Участие нитропроизводных (производных нитритов и нитратов) во многих патологических процессах, в том числе и опухолевом росте, было известно давно. Первоначально разрозненные и часто необъяснимые данные о связи противомикробного и противоопухолевого действия макрофагов и нитропроизводных прояснились после открытия синтеза NO в эндотелиальных клетках. Действие макрофагов на чужеродные агента также стали связывать с NO, и многочисленные эксперименты подтвердили, что макрофаги способны синтезировать NO-синтазу и выделять большое количество газа [2]. Уже отмечалось, что NO-синтаза макрофагов является индуцибельным ферментом. В нормальных условиях клетки не содержат этот фермент и не продуцируют NO [10]. Под влиянием липополисахаридов микробного происхождения или цитокинов - высокоактивных межклеточных посредников, выделяющихся, в частности, лимфоцитами при их контакте с чужеродными агентами, в макрофагах начинается синтез индуцибельной изоформы NO-синтазы, образующей большой объем NO, оказывающего, в свою очередь, цитостатическое и цитолитическое действие на бактериальные и чужеродные (в том числе и раковые) клетки [2].
Нейтрофилы также способны экспрессировать индуцибельную форму NO-синтазы и синтезировать NO, однако данные о цитотоксическом действии этих клеток, связанном с NO, неизвестны.
Известно, что нейтрофилы и макрофаги способны активно образовывать свободные радикалы кислорода, и, возможно, образование пероксинитрита в реакции NO со свободными радикалами может усиливать антимикробный эффект этих клеток [2].
NO и кровеносные сосуды
Значение NO в кровоснабжении многогранно. Прежде всего NO - мощный сосудорасширяющий агент. Эндотелий постоянно продуцирует небольшие количества NO (так называемый базовый фон), а при различных воздействиях - механических (например, при усилении тока или пульсации крови), химических бактериальных и вирусных - синтез NO в эндотелиальных клетках значительно повышается [2].
Расширение сосудов связано с диффузией NO из эндотелия к соседним гладкомышечным клеткам стенки сосуда, активацией в них гуанилатциклазы и образованием цГМФ [8]. Повышение уровня цГМФ приводит к снижению уровня ионов кальция в цитозоле клеток и ослаблению связи между миозином и актином, что и позволяет клеткам расслабиться, то есть принять первоначальную форму и размеры. Следует помнить, что расслабление мышечных клеток обусловлено не внутриклеточными процессами, а связано с внешними по отношению к клеткам механическим факторам, в частности для гладких мышц сосудов это упругость эластических волокон, окружающих и оплетающих гладкомышечные клетки и растягивающих клетки после прекращения процесса сокращения и устранения связи между актином и миозином [2].
Действует NO очень быстро - образование цГМФ происходит через 5с, а начало расслабления гладких мышц - через 10с после добавления NO в культуру изолированных кровеносных сосудов. Открытие сосудорасширяющего действия NO позволило прояснить механизм действия самого распространенного и эффективного лекарственного средства, применяемого для лечения спазма коронарных артерий - нитроглицерина. При расщеплении препарата образуется NO, приводящий к расширению сосудов сердца и снимающий в результате этого чувство боли [2].
Большое значение NO имеет в регуляции мозгового кровообращения. Известные более ста лет назад данные об усилении кровотока в активно работающих областях мозга получили после открытия сосудорасширяющего действия NO более полную интерпретацию. Имеется несколько источников NO для регуляции просвета мозговых сосудов [8]. Это эндотелий сосудов, нейроны, содержащие NO-синтазу и оплетающие своими отростками стенки сосудов и астроциты, образующие периваскулярные оболочки (рис. 3). Активация нейронов какой-либо области мозга приводит к возбуждению нейронов, содержащих NO-синтазу, и/или астроцитов, в которых также может индуцироваться синтез NO, и выделяющийся из клеток газ приводит к локальному расширению сосудов в области возбуждения [2].
С NO связывает и развитие септического шока, когда большое количество микробов, циркулирующих в крови, резко активирует синтез газа в эндотелии, что приводит к длительному и сильному расширению мелких кровеносных сосудов и как следствие - значительному снижению артериального давления, с трудом поддающемуся терапевтическому воздействию [2].
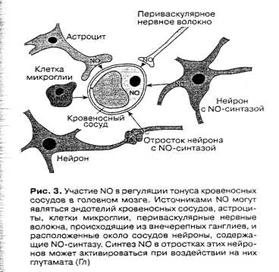
Рис. 5. Участие NO в регуляции тонуса кровеносных сосудов в головном мозге [2].
NO, образующийся в эндотелии, оказывает влияние и на взаимодействие клеток крови с эндотелием. Газ препятствует прилипанию лейкоцитов и кровяных пластинок к эндотелию и также снижает агрегацию последних [9]. Такое действие NO может иметь большое значение на ранних стадиях развития тромбов и в генезе атеросклеротических повреждений стенки сосудов. Участие NO в развитии атеросклероза может заключаться и еще в одной стороне его действия. NO может выступать в роли антиростового фактора, препятствующего пролиферации гладкомышечных клеток стенки сосудов, важного звена в патогенезе болезни [2].
NO и нервная система
В нервной системе NO имеет большое значение, как в нормальных физиологических условиях, так и при различной патологии. Источниками NO в ЦНС являются нейроны, нейроглиальные клетки - астроциты и клетки микроглии и эндотелий кровеносных сосудов [2].
Нейроны, содержащие NO-синтаза, находятся во многих отделах ЦНС и большинстве изученных периферических ганглиев нервной системы. В коре больших полушарий в среднем 2% нейронов содержат NO-синтазу, в большинстве отделов головного мозга число таких нейронов также невелико. Однако имеются области и с высоким их содержанием. Так, максимальное количество нейронов, содержащих NO-синтазу, находится в коре мозжечка, где большинство клеток-зерен и корзинчатых нейронов содержат фермент [8]. Самые крупные нейроны коры мозжечка - клетки Пуркинье - не содержат NO-синтазу. Сравнительно много нейронов, содержащих NO-синтазу, находится в обонятельных луковицах, а также в некоторых отделах гиппокампа и полосатого тела. Только в мозжечке нейроны, содержащие NO-синтазу, составляют компактную популяцию клеток, а в остальных отделах - это одиночные, редко расположенные клетки (рис. 4) [2].

Рис.6. Нейроны, содержащие NO-синтазу, в коре больших полушарий белой крысы [2].
Обобщая имеющиеся данные о нейронах ЦНС, содержащих NO-синтазу, следует отметить, что преимущественная часть их относится к небольшим по размерам клеткам, многие из которых не содержат дендритных шипиков и являются ассоциативными нейронами. Крупные клетки, например пирамидные нейроны коры больших полушарий или гиппокампа, моторные нейроны передних рогов спинного мозга, не содержат NO-синтазу. NO-синтаза сосуществует в нервных клетках с другими традиционными нейромедиаторами и нейропептидами, чаще фермент определяется в холинэргических нейронах [2].
Большое внимание уделяется NO в реализации нервных воздействий на ткани внутренних органов. Нервы, содержащие NO-синтазу, показаны практически во всех изученных внутренних органах, преимущественно в стенке кровеносных сосудов, где они, наряду с эндотелием, могут оказывать сосудорасширяющий эффект [8] NO признается одним из основных эффекторных агентов в так называемых неадренэргических-нехолинэргических нервах. В периферических нервах подробно изучено сосуществование NO-синтазы с нейропептидами. Наиболее часто фермент определяется вместе с вазоактивным кишечнымнейропептидом (VIP) и нейропептидом Y [2].
Значение NO в ЦНС в нормальных условиях связывают с тремя процессами (так называемая NO-гипотеза):
1) Участие в межнейронной связи в качестве своеобразного нейромедиатора, причем основное значение, как полагают, NO имеет в синаптической пластичности, под которой понимают эффективность синаптической передачи;
2) Регуляция церебрального кровотока;
3) Установление межнейронных синаптических взаимосвязей во время развития нервной системы[2].
NO как нейромедиатор
Нейромедиаторная сущность NO заключается в том, что оно синтезируется при возбуждении нейрона (в ответ на поступление ионов кальция) и, диффундируя в соседние клетки, активизирует в них образование цГМФ, способного влиять на проводимость ионных каналов и, таким образом, изменять электрогенез нейронов [2]. NO отличается от традиционных нейромедиаторов тем, что он оказывает воздействие на ионные каналы не через плазмалеммальные рецепторы, а изнутри, со стороны цитоплазмы. Кроме того, действие NO не ограничивается только областью синаптических контактов, газ может влиять на ионные каналы на значительной площади плазматической мембраны нейрона [11].
Участие NO в синаптической пластичности наиболее ярко проявляется в таких процессах, как длительная синаптическая потенция (повышение эффективности проведения возбуждения через синапс для каждого последующего импульса в их последовательности), более детально проанализированная в гиппокампе, и длительная синаптическая депрессия (снижение эффективности проведения возбуждения через синапс), лучше исследованная в коре мозжечка[2].
В первом случае возбуждение постсинаптического окончания приводит к повышению внутриклеточного уровня Ca2+/кальмодулина, активирующих NO-синтазу и образование NO. NO, диффундируя в пресинаптическое окончание, вызывает образование цГМФ, что приводит к усилению и увеличению длительности выделения из пресинапса нейромедиатора, который оказывает возбуждающее действие на постсинаптический нейрон, и таким образом возникает обратная положительная связь с постоянным усилением. Такому механизму особое влияние уделяется в синапсах с наиболее распространенными и сильновозбуждающими нейромедиаторами ЦНС глутаматом и особому глутаматному рецептору - NMDA- рецептору, являющемуся трансмембранным каналом для ионов кальция (рис 7) [2].
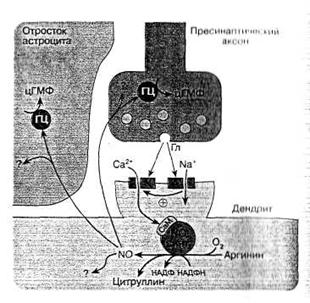
Рис. 7. Схема возбуждающего глутаматного синапса ЦНС и возможное участие NO в его деятельности [2].
Выделяющийся из синаптических пузырьков возбуждающий нейромедиатор глутамат (Гл) влияет на АМРА (А)-рецепторы, что приводит к деполяризации плазматической мембраны и открытию NMDA(N)-каналов (последнее связано с высвобождением вследствие изменения потенциала мембраны из ионного канала ионов магния, которые закрывали канал). Через NMDA-каналы в клетку поступает большой объем ионов кальция, активирующих конститутивную изоформу NO-синтазы. Образующийся NO, диффундируя в пресинаптический аксон, активирует в нем гуанилатциклазу (ГЦ) и синтез цГМФ, последний способствует усилению выделению нейромедиатора глутамата, что повышает эффективность синаптической передачи (феномен длительной синаптической потенции). NO может также влиять на окружающие астроциты и активировать в них гуанилатциклазу.
Дополнительные обозначения: СаМ - кальмодулин; ? - возможное влияние NO на другие не связанные с гуанилатциклазой клеточные системы нейронов и астроцитов.
С длительной синаптической потенцией, прежде всего в гиппокампе, связывают пластичность межнейронных связей, лежащих в основе памяти. Такое предположение основывается на ставших уже классическими представлениях Д.Хэбба (1949) о повышении эффективности синаптической передачи при возбужденном состоянии постсинаптического нейрона. Физиологические наблюдения об участии NO в процессах памяти и обучения противоречивы. Наряду с работами, в которых показано нарушение процессов обучения у экспериментальных животных при введении ингибиторов NO-синтазы, имеются и исследования с противоположными результатами. Неоднозначность получаемых результатов, возможно, связана с тем, что вводимые в организм ингибиторы NO-синтазы оказывают действие не только на всю нервную систему, но и на все органы и ткани животных, что не позволяло достичь локального влияния на продукцию NO в мозге [2].
В переживающих (живущих некоторое время в условиях культуры тканей) срезах головного мозга был показан и другой механизм действия NO на пресинаптические окончания. NO способен инициировать выделение нейромедиатора дофамина из нейронов не посредством экзоцитоза, а путем трансмембранной диффузии при участии особого мембранного переносчика дофамина, участвующего в его захвате из межклеточной среды [8]. В этом процессе не участвует цГМФ и предполагается прямое влияние NO на транспортные белки мембран [2].
Длительную синаптическую депрессию, в частности в контактах между параллельными волокнами, являющимися аксонами самых маленьких нейронов в организме человека, так называемых клеток-зерен, и нейронами Пуркинье в коре мозжечка, связывают с десенсибилизацией другого класса глутаматных рецепторов, так называемых АМРА-рецепторов. Выделяющийся из аксонов корзинчатых нейронов NO диффундирует к нейронам Пуркинье и активирует в них синтез цГМФ, что приводит к инактивации АМРА-рецепторов и снижению эффективности работы синапсов между клетками-зернами и нейронами Пуркинье [13].
В основе первого положения NO-гипотезы (см. выше) лежит возможность образования NO в постсинаптическом окончании при его возбуждении влияние газа на пресинаптический аксон. Однако за счет диффузии к соседним нервным клеткам NO может оказывать влияние не только на пресинаптическое расширение аксона, формирующего синапс на этом постсинаптическом окончании, но и на близлежащие аксоны и дендриты, модулируя их активность (рис. 6) [2].
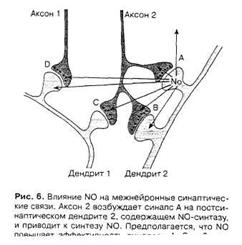
Рис.8. Влияние NO на межнейронные синаптические связи [2].
Традиционная формулировка положения об участии NO в межнейронной коммуникации ограничивается обычно возможностью синтеза и выделения NO из локальной области нейрона - постсинаптического окончания. Однако, как показывают результаты свето- и электронно-микроскопических исследований, NO-синтаза определяется во всем объеме тела нейронов - в перикарионе, аксоне и дендритах. Поскольку при возбуждении нейрона по всей длине его отростков и в теле уровень кальция циклически колеблется (образуются своеобразные кальциевые волны), можно считать, что синтез и выделение NO могут инициироваться в любом участке тела и отростков нейронов. Таким образом, нейроны, содержащие NO-синтазу, способны создавать вокруг себя поле воздействия, то есть могут считаться своеобразными полевыми нейронами в отличие от традиционных нейронов, связанных друг с другом в локальных участках - синапсах [2].
Основное внимание в процессах синаптической пластичности уделяется нейронам, однако нельзя не учитывать и роль глии. Известно, что астроциты способны продуцировать NO, причем они обладают как конститутивной (в небольшом количестве), так и индуцибельной NO-синтазой [8]. Если принять во внимание, что число астроцитов в 10-100 раз превосходит (в зависимости от области мозга) количество нейронов, то их роль в продукции NO и влиянии на механизмы электрогенеза нейронов может являться весьма значимой [2].
Значение астроцитов как источника NO особенно ярко проявляется при патологии ЦНС. При многих нейродегенеративных заболеваниях, ишемии, травмах, опухолях головного мозга астроциты начинают экспрессировать NO-синтазу и продуцировать большой объем NO. С этим связывают гибель нейронов и других макроглиальных клеток, в частности олигодендроцитов [2].
Значение NO в развитии нервной системы
Целенаправленный рост и ветвление отростков нейронов, установление новых синаптических контактов в процессе развития нервной системы во многом определяются возбуждение нервных клеток. Нейроны, содержащие NO-синтазу, показаны еще в эмбриональном периоде, и, как полагают, NO может инициировать развитие растущих аксонных и дендритных веточек и стимулировать образование синапсов. Эта область нейробиологии остается еще малоисследованной [2].
Роль оксида азота в развитии патологических состояний
Токсический эффект NO проявляется прежде всего в ингибировании митохондриальных ферментов, что приводит к снижению выработки АТФ, а также ферментов, участвующих в репликации ДНК. Кроме того, NO и пероксинитрит могут непосредственно повреждать ДНК, это приводит к активации защитных механизмов, в частности стимуляции фермента поли(АДФ-рибоза)синтетазы, что еще больше снижает уровень АТФ и может приводить к клеточной гибели. Повреждение ДНК под влиянием NO является одной из причин развития апоптоза, особого вида клеточной смерти, регулирующейся геномом клетки [2].
Следует отметить еще одно интересное наблюдение, связанное уже с нейронами, содержащими NO-синтазу, и не получившее пока полного объяснения. Еще в 60-х годах Е. Томас и Э. Пирс использовали новый гистохимический метод выявления активности фермента НАДФН-диафоразы (фермент, способный восстанавливать окисленную форму НАДФ) для анализа нервной системы и показали, что в разных отделах головного мозга имеются единичные нейроны с интенсивной положительной реакцией. Эти нейроны, которые получили название «одиночные активные клетки», остаются неповрежденными при разнообразной патологии нервной системы, в то время как большинство других клеток погибает [8]. Относительно недавно выяснилось, что НАДВН-диафоразная активность свойственна NO-синтазе, и, таким образом, была установлена устойчивость нейронов, содержащих NO-синтазу, к разнообразным патологическим воздействиям. Механизмы такого необычного и имеющего большое биологическое значение свойства клеток окончательно не выяснены [2].
Остается не выясненным и вопрос о том, почему большие дозы синтезированного газа не оказывают токсического воздействия на клетки, в которых они образуются. Одним из возможных объяснений такого парадокса может быть то, что в нейронах, содержащих NO-синтазу, определяется высокая активность фермента супероксиддисмутазы, катализирующей распад токсических радикалов и защищающей клетку от губительного действия [2].
Результаты последних исследований позволили предположить, что активация NO-синтазы может выполнять не только положительную роль, но и оказывать повреждающее действие на клетки. Это связано с разнонаправленным действием механизмов, опосредующих эффекты NO, в результате чего ответ клетки на один и тот же стимул может быть существенно разным [3].
Примерами токсического действия NO являются основные нейродегенеративные заболевания ЦНС, такие как ишемический инсульт, эпилепсия и другие судорожные расстройства, болезни Паркинсона и Альцгеймера, боковой ангиотрофический склероз и т.д. В основе развития этих расстройств лежит избыточная продукция оксида азота в результате гиперактивации глутаматных рецепторов NMDA-подтипа, ведущей к повышению содержания внутриклеточного кальция и активации NO-синтазы [3].
Также выявлено участие оксида азота в развитии инсулинозависимого диабета, при этом непосредственной мишенью действия NO и других свободных радикалов является ДНК β-клеток островков Лангерганса [8].
Избыточная продукция NO индуцибельной формой NO-синтазы - важное звено в патогенезе острой недостаточности кровообращения при тепловом, кардиогенном, септическом и других видах шока [3].
В то же время, действие ряда факторов (липопротеины низкой плотности, высокие концентрации глюкозы и ишемия) может вызывать снижение продукции NO как за счет ингибирования NO-синтаз, так и за счет снижения их экспрессии. При этом низкий уровень оксида азота приводит к повышению тонуса сосудов, свертываемости крови и снижению иммунитета, тем самым способствуя развитию гипертензии, атеросклероза, тромбозов, ишемической болезни сердца, инфекционных заболеваний и опухолевого роста [3].
Таким образом, возникает необходимость в модулирующем воздействии на системы генерации NO c тем, чтобы поддержать или усилить защитное и физиологическое действие NO и, в то же время, устранить или ограничить его повреждающие эффекты [9]. По последним данным, эффекты оксида азота зависят не только от концентрации, но также от места его продукции, диффузии в клетках и тканях, образования NO-содержащих соединения, взаимодействия с реактивными формами кислорода (в особенности с супероксид-анион радикалом) и, возможно, от других факторов [3].
Таким образом, для понимания процессов, лежащих в основе перехода защитных эффектов этого агента в повреждающие, а также для выработки новых стратегий лечения необходимо установить роль этих факторов в проявлении биологической активности NO [3].
Патогенез различных заболеваний и проблемы их терапии в связи с обменом азота в организме
Учитывая важные физиологические функции NO в интактном организме, можно не сомневаться, что в случае заболевания этот радикал будет вовлечен в развитие многих патологических реакций. В настоящее время в эксперименте и клинике активно изучают следующие группы заболеваний, для развития которых характерны изменения в обмене NO*: болезни сердечно-сосудистой системы, в том числе гипертонию, инфаркт миокарда, легочную гипертензию, атеросклероз; инсульты и поздние дегенеративные заболевания нервной системы; различные аутоиммунные заболевания, диабет, отторжение трансплантатов; процессы острого и хронического воспаления различных органов и тканей, особенно эндотоксемию, отек, шок; цирроз печени, болезнь почек, легких, ЖКТ; онкологические заболевания [1].
В современных медицинских исследованиях активно изучается возможность использования NO* как ингибитора развития атеросклероза в связи с его способностью влиять на повреждающее действие гомоцистеина на сосудистую стенку, на образование комплексов окисленного холестерина с липопротеинами низкой плотности и на последующее развитие атеросклеротических бляшек. Показано также, что обмен NO* вовлечен в антиатерогенное действие эстрогенов [11].
Оксиды азоты обычно обнаруживаются при хронических воспалительных процессах в кишечнике, при язве желудка, артритах. Ингибиторы NO-синтазы значительно снижают выраженность воспалительных процессов. При длительных воспалительных состояниях возможно истощение источника NO* - L-аргинина или кофактора NO-синтазы - H4Б. в этом случае фермент начинает восстанавливать внутриклеточный кислород до супероксид-радикала и перекиси, нарушая таким образом антиоксидантную защиту клеток. Поскольку хронические воспалительные состояния характеризуются локальным накоплением различных оксидов азота в окружающих тканях, им могут сопутствовать процессы нитрозилирования аминов и ДНК [1].
Следует также отметить важную роль оксида азота в естественной резистентности организма, устойчивости к стрессу, пребыванию в так называемом третьем состоянии (ни здоровье, ни болезнь), в изменениях работоспособности [1].
Место оксида азота в биологии злокачественных новообразований только начинает исследоваться. Тем не мене известно, что продукты модификации аминов реактивными окислами азота принимают участие в процессах злокачественного перерождения клеток. Большинство из компонентов, регулирующих рост новообразований, - эндотелиальные клетки сосудов опухоли, инфильтрирующие иммунные клетки и сами опухолевые клетки - могут генерировать NO. Процесс опухолевого роста в значительной мере зависит от способности опухолевых макрофагов к экспрессии NO-синтазы. Возможно, оксид азота имеет отношение и к метастазированию опухолей. Так, показана отрицательная корреляция между активностью индуцируемой NO-синтазы и образованием метастазов меланомы у экспериментальных животных. Повышенная и длительная продукция оксида азота на фоне тканевой гипоксии и синтеза противовоспалительных цитокинов может, с одной стороны, приводить к активации онкогена p53 на формирование мутантных клеток, дающих начало росту опухоли, а с другой стороны, способствовать выработке ангиостимулирующего фактора, обеспечивающего развитие сосудистой сети опухоли. Накапливаются свидетельства о перспективности использования в противоопухолевой терапии агентов, модифицирующих синтез NO. Это относится не только к индукции гибели опухолевых клеток, но и к регуляции тонуса опухолевых сосудов [1].
Имеются данные о радиосенсибилизирующих свойствах экзогенных источников оксида азота, что может представлять интерес для комбинированной радиотерапии опухолей. Интересно, что ингибитор NO-синтазы - метиловый эфир нитроаргинина - существенно снижает токсические эффекты противоопухолевого препарата цис -платины у крыс [6]. Поэтому изучение роли изменений обмена оксида азота в индукции, прогрессии и росте опухоли и в ее чувствительности к таким лечебным воздействиям, как ионизирующая радиация, химиопрепараты, электромагнитная гипертермия и их сочетания, может оказаться весьма перспективным для совершенствования существующих и разработки новых методов профилактики и терапии рака [1].
Роль оксида азота как регулятора клеточных процессов при формировании полиорганной недостаточности
В последние годы в связи с развитием проблемы так называемой полиорганной недостаточности как последствия критических состояний, шока, а также крайне тяжелых послеоперационных осложнений все большее внимание привлекает патогенез универсального механизма поражения отдельных органов и целостных функциональных систем. Помимо прямого воздействия поражающих факторов (нарушения циркуляции, в том числе микроциркуляции, потери объема циркулирующей крови, механических повреждений клеток, инфекции и др.), являющихся пусковым моментом, на последующих этапах на передний план начинают выступать процессы, обусловленные патологическим накоплением агрессивных медиаторов. Совокупность указанных причин и определяет чрезвычайно высокую летальность как результат полиорганной недостаточности [5].
Среди таких медиаторов, наряду с цитокинами, лейкотриенами, простагландинами, пептидами, большое функциональное значение имеет оксид азота (NO). Его участие в биологической регуляции функций явилось для биологов и медиков определенной неожиданностью. К настоящему времени выявлены далеко не все регуляторные эффекты NO, но уже сейчас ясно, что достигнутые в этой области успехи имеют фундаментальное значение для понимания молекулярных механизмов многих физиологических и биохимических процессов [5].
Прежде чем приступить к рассмотрению конкретных примеров проявления биологической активности NO у человека и животных, следует еще раз указать на полифункциональность его действия, которую нельзя сводить только к «положительным» или только к «отрицательным» эффектам [8]. Биологический ответ на NO в значительной степени определяется условиями его генерации - где, когда и в каком количестве продуцируется это соединение [5].
Все многообразие биологических эффектов NO можно разделить на 3 типа:
1. Регуляторное влияние NO на сосудистый тонус, адгезию клеток, проницаемость сосудов, нейротрансмиссию, бронходилатацию, агрегацию тромбоцитов, систему противоопухолевого иммунитета, функцию почек.
2. Защитное действие NO, проявляющееся в его антиоксидантной активности, ингибировании адгезии лейкоцитов и защите от токсического воздействия фактора некроза опухолей α.
3. Повреждающее действие NO, проявляющееся в ингибировании ряда ферментов, нарушении структуры ДНК, индукции процессов перекисного окисления липидов, снижении антиоксидантного потенциала клеток, повышении их чувствительности к радиации, алкилирующим агентам и токсичным ионам металлов [5].
Действие NO осуществляется через прямые и опосредованные эффекты: прямые эффекты наблюдаются в тех случаях, когда с биологическими макромолекулами взаимодействует сам NO; опосредованные эффекты реализуются не NO, а продуктами его взаимодействия с другими соединениями, в первую очередь О2 и О-2 [5].
Ярким примером прямого регуляторного действия NO может служить его вазодилататорная активность. Сосудорасширяющее действие NO связано с активацией растворимой формы фермента гуанилатциклазы [10]. Гуанилатциклаза катализирует биосинтез циклического 3,5-гуанозинмонофосфата (цГМФ) из гуанозинтрифосфата. Как известно, цГМФ оказывает модуляторное действие на многие клеточные процессы. Характерной особенностью растворимой гуанилатциклазы является присутствие в ней гемовой группы. NO связывается с Fe гемма и специфично изменяет его структуру. Такая структурная перестройка приводит к резкому возрастанию активности гуанилатциклазы (до 400-кратного) и накоплению цГМФ. Активизирующее действие NO проявляется при его очень низких концентрациях [5].
По-видимому, цГМФ оказывает действие на различные функции сосудов, но наиболее изученным до сих пор является его влияние на вазодилатацию. В этом процессе, кроме цГМФ, ключевые роли играют цГМФ-зависимая протеинкиназа, Са2+-АТФаза и Са2+ [5].
В связи с вазодилататорными и другими биологическими эффектами NO в научной литературе активно обсуждается вопрос об использовании экзогенных доноров NO, т.е. соединений, биотрансформация которых в организме человека приводит к образованию NO, в лечебных целях, вероятно, к числу таких доноров можно отнести известные нитровазодилататоры (нитроглицерин, нитросорбит) [5].
Вазодилататорное действие NO осуществляется не только путем активации гуанилатциклазы, но и в результате обратимого ингибирования цитохромоксидазы [9]. Ингибирование цитохромоксидазы в сосудистой ткани вызывает нарушение энергетического метаболизма, а это, вероятно, приводит к расслаблению сосудов за счет гиперполяризации мембраны, обусловленной открытием АТФ-зависимых калиевых каналов, а также за счет снижения уровня АТФ, необходимого для функции сократительного аппарата [5].
К настоящему времени накоплен обширный экспериментальный материал, касающийся защитного и повреждающего действия NO на различные клетки.
Вопрос о механизмах гибели клеток, органов и всего организма является одной и центральных проблем биологии и медицины.
Если рассматривать организм как сложную самоуправляющуюся и управляемую систему клеток, то смерть большей или меньшей совокупности клеток, а затем и органа или целой физиологической системы организма и будет предпосылкой смерти всего организма. Смерть клетки может происходить двумя путями: путем так называемого суицида (апоптоз) и в результате воздействия внешних факторов, т.е. путем формирования так называемого sick cell syndrome, в котором непосредственный механизм смерти клетки, а далее и всего организма, т.е. танатогенез, обусловлен гипоксией, эндо(экзо)токсикозом и иммунным конфликтом. Эти варианты характеризуются различными морфологическими и молекулярными явлениями и разным влиянием на окружающие ткани [5].
Термин «апоптоз» был предложен Керром (J. F. R. Kerr) еще в 1972 году для обозначения активного процесса разрушения клетки, характеризуемого ее сжатием, агрегацией хроматина, фрагментацией генома и пикнозом ядра. Апоптоз играет важную роль в поддержании нормального тканевого гомеостаза, и нарушение его регуляции может являться причиной различных патологических состояний, включая раковые заболевания.
Часто апоптоз называют процессом запрограммированной гибели клеток, поскольку он запускается внешними сигналами, поступающими от поверхностных рецепторов клетки, осуществляется по строго определенному механизму и жестко контролируется специфичными внутриклеточными регуляторными системами. Исходные сигналы могут иметь внутриклеточное происхождение, связанное с действием фармакологических преператов и токсинов. Апоптоз обычно происходит в отдельных клетках и не сопровождается выделением медиаторов воспаления. Расщепление ДНК начинается на ранних этапах апоптоза и характеризуется образованием фрагментов длиной 180-200 пар оснований (нуклеосома) и кратных им [5].
Процессы передачи инициирующих сигналов апоптоза к эффекторным механизмам, ответственным за гибель клеток, находится под жестким контролем, обеспечиваемым сложным взаимодействием регуляторных белков.
Важную роль в передаче сигнала и/или осуществлении апоптической гибели клеток играют протеазы семейства интерлейкин-1β-превращающих ферментов, называемые каспазами. Каспазы формируют каскад протеолитических процессов, усиливающих первоначальный апоптический сигнал. Большинство известных внутриклеточных субстратов каспаз включаются в механизмы клеточной репарации, регуляцию клеточного цикла и поддержание клеточных структур. Причинная связь расщепления субстратов с апоптической гибелью клеток не вполне ясна, однако разрушение некоторых из них может сделать процесс гибели неизбежным. Примером такого белкового субстрата может служить поли(АДФ-рибозо)полимераза [5].
В зависимости от типа клеток NO может либо способствовать апоптозу, либо защищиать их от апоптической гибели. Апоптоз, обусловленный действием NO, был впервые продемонстрирован на мышиных моноцитах/макрофагах линии RAW 264.7. в последующих работах было показано, что NO участвует в апоптозе нейронов и хондроцитов [8].
Имеется значительное число научных публикаций, убедительно свидетельствующих об эффективном защитном действии NO против клеточного апоптоза. Имеются сведения об антиапоптотическом действии NO на гепатоциты in vivо. Аналогичное влияние NO оказывает на тимоциты и лимфоциты [5].
Среди многочисленных патологических состояний, в развитии которых важная роль принадлежит NO, особое место занимает септический шок. Продукция NO в условиях септического шока в клетках различных типов имеет системный характер. Одним из центральных органов, клетки которого генерируют NO при септическом шоке, является печень.
Печень играет центральную роль во многих метаболических и иммунных процессах. Функционирование печени в номе и при патологии определяется сложными взаимодействиями гетерогенных популяций клеток, формирующих печень. Они включают собственно печеночные (паренхиматозные) клетки печени (гепатоциты), эндотелиальные клетки сосудов, макрофаги-резиденты (клетки Купфера), клетки желчных каналов и тучные клетки (клетки Стеллата или клетки Ито). Клетки Купфера по своему происхождению моноциты, составляют 80-90% общей популяции макрофагов в организме. Поскольку индуцированная генерация NO обнаруживается в клетках всех этих типов, есть основания утверждать, что NO участвует в большинстве метаболических процессов, протекающих в печени [5].
Накопленные к настоящему времени основные сведения о роли NO в регуляции функциональной активности гепатоцитов можно суммировать следующим образом.
1. Влияние NO на синтез белка . В условиях генерации NO наблюдается ингибирование синтеза белка в гепатоцитах в культуре. Механизм такого ингибирования остается неясным. Он не обусловлен возможной потерей жизнеспособности клеток или высвобождением гепатоцеллюлярных ферментов. Блокада белкового синтеза в гепатоцитах осуществляется по цГМФ-независимому пути. Однако в экспериментах на животных in vivo было показано усиление синтеза белка в гепатоцитах на септической модели в условиях экспрессии NO-синтазы. Вопрос о влиянии NO на синтез белка нуждается в дальнейшем изучении.
2. Ингибирование глюконеогенеза и гликогенеза . Поскольку доноры NO подавляют гликогенолиз в печени животных, можно говорить о регулирующем влиянии NO на гомеостаз глюкозы. На септических моделях наблюдается ингибирующее влияние NO на процессы глюконеогенеза.
3. Активация растворимой гуанилатциклазы . NO вызывает накопление цГМФ в гепатоцитах животных, но в целом роль цГМФ в физиологии гепатоцитов еще не изучена.
4. Влияние NO на систему цитохрома Р -450. как известно, одной из важнейших функций печени является метаболизм ксенобиотиков, осуществляемый локализованными в микросомах гепатоцитов монооксигеназами со смешанной функцией, объединяемыми общим названием цитохромов Р-450. к ксенобиотикам относятся разнообразные лекарственные средства, токсины, канцерогены и другие чужеродные для организма соединения. Было показано, что NO способен не только ингибировать активность цитохромов Р-450, но и подавлять их экспрессию при воспалении. Действие специфично к отдельным изоферментам цитохрома Р-450. наблюдаемое в клинике изменение метаболизма ряда лекарственных и токсических соединений в печени при некоторых системных воспалительных процессах связано в первую очередь с активностью NO [5].
Влияние NO на печень не ограничивается септическими состояниями. Имеются сведения о важной роли NO в функциональных сдвигах, наблюдаемых в печени при ишемии и реперфузии, злокачественных новообразованиях, циррозе и ряде др. патологических состояний [12].
В медицинском плане более перспективными представляются способы регуляции NO с помощью специфических ингибиторов отдельных форм NO-синтаз и доноров NO, способных избирательно воздействовать на клетки и ткани. К сожалению, синтезируемые к настоящему времени специфичные ингибиторы, например N5-(1-имно-3-бутенил)-L-орнитин, не обладают абсолютной избирательностью. Одной из перспективных мишеней противовоспалительной терапии может оказаться ядерный фактор транскрипции NFkB. Однако при любом подходе к решению проблемы регуляции NO необходимо иметь в виду, что NO - вездесущий медиатор метаболизма и резкое изменение его генерации может привести к нарушению функциональной активности многих биосистем [5].
Фармакологические возможности регуляции содержания окиси азота в организме
Уникальные биологические свойства NO и его участие в разнообразных физиологических и патофизиологических процессах дают основания для использования данного соединения (путем управления его содержанием) в профилактических и лечебных мероприятиях. Существуют следующие способы изменения содержания NO, вытекающие из данных о L-аргинин-NO-метаболизме:
· регуляция уровня субстрата (L-аргинина);
· активация/индукция/ингибирование NO-синтаз;
· защита или инактивация NO.
Кроме того, в качестве терапевтических средств могут применяться экзогенные доноры NO или само соединение в виде компонента газовой смеси.
В последнее время были получены новые сведения о механизмах действия фармакологических агентов, известных как нитровазодилататоры (НВД). Оказалось, что существенная доля вызываемых ими биологических эффектов связана метаболическими превращениями органических нитратов в организме, сопровождающимися выделением NO. Во многих случаях эти препараты, по-видимому, заменяют эндогенные источники NO в организме, дефектные при патологических состояниях. На эффективность выделения NO из НВД влияет присутствие низкомолекулярных тиолов (наиболее активен цистеин). Многими исследователями продемонстрировано также антитромботическое действие НВД, которое развивается параллельно с релаксацией гладкой мускулатуры сосудов и также требует в отдельных случаях присутствия тиолов. Очевидно, что понимание механизмов действия NO в организме необходимо при разработке новых препаратов - доноров NO для преодоления индуцироемой нитратами резистентности сосудов к релаксации или эндотелиальной дисфункции, сопровождающей многие заболевания (атеросклероз, гипертонию, диабет и др.) [1].
Основные стадии синтеза NO, через которые возможна регуляция содержания NO в организме, представлены ниже.
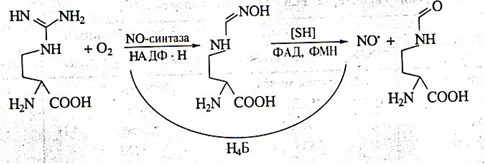
Рис. 9. Схема синтеза оксида азота из L-аргинина.
Перспективность использования L-аргинина как полузаменимой аминокислоты в терапии ряда патологий известна давно: дефицит аргинина приводит к дисфункции семенников, экзогенный аргинин оказывает защитное действие при гипероксии, гипотермии, поражении печени, повышает уровень инсулина и соматотропного гормона, ускоряет отторжение трансплантата, регрессию экспериментальных опухолей [13]. Однако в какой степени достигаемые эффекты (снижение артериального давления, коррекция эндотелиальной дисфункции при гиперхолистеринемии, терапия гломерулонефрита) опосредуются через NO, остается пока невыясненным. Снижение содержания аргинина в организме возможно также с помощью фермента аргиназы, превращающей его в орнитин. О возможности управления содержанием NO через модуляцию уровня кофакторов NO-синтаз свидетельствуют данные об индукции ее образования в изолированных сосудах ингибитором синтеза тетрагидроптерина - 2,4-диамино-гтдроксипиримидином.
Широкое применение в экспериментальных исследованиях нашли различные ингибиторы NO-синтаз. Однако необходим дальнейший поиск агентов, подавляющих синтез NO (например, анестетики), с приемлемыми фармакологическими характеристиками. Те же требования могут быть предъявлены и к активаторам синтеза NO, среди которых агонисты, иммуномодуляторы и др. содержание самого NO может модулироваться уровнем супероксидрадикала или других перехватчиков: железосодержащих соединений, гемоглобина. Окись азота уже испытана в качестве терапевтического агента при различных заболеваниях легких) гипертония, астма и др.) [1].
Заключение
Таким образом, образование NO при ферментативном окислении L-аргинина является уникальным биохимическим феноменом. Эксперименты на животных показали его чрезвычайно важную роль в регуляции сосудистого тонуса, активности тромбоцитов и лейкоцитов, нейропередаче и нейромодуляции, в обеспечении толерантности организма к патогенам. Некоторые из этих функций NO начинают успешно использоваться в терапии ряда заболеваний легких, сосудов, мозга [1]. Применение уже известных фармакологических средств и разработка новых для воздействия на физиологические и патофизиологические процессы, опосредуемые оксидом азота, несомненно, приведет к значительному прогрессу в лечении таких распространенных заболеваний, как атеросклероз, гипертония, диабет и др. Кроме того, следует учитывать биологические явления, связанные с NO, при изучении побочных эффектов традиционных терапевтических препаратов, а также вновь разрабатываемых средств для применения в иных областях медицины [1].
Открытие высокоактивного межклеточного посредника - NO позволило прояснить многие неясные вопросы жизни клеточного сообщества в организме человека и животных. В 1992 году NO в знак большого интереса к ней исследователей был назван молекулой года. В 1998 году Р. Фуршготт, Л. Игнарро и Ф. Мурад за работы по выяснению механизмов, связанных с участием NO, получили высшую оценку мировой науки - Нобелевскую премию. Однако, как это всегда бывает на пути познания, новое порождает еще больше вопросов. По-видимому, NO еще долго будет привлекать внимание исследователей, и можно надеяться, что будут получены новые интересные и значимые результаты [2].
Список используемой литературы
оксид азот синтаза фермент
1. С.Я. Проскурянов, А.Г. Конопляников, А.И. Иванников, В.Г. Скворцов «Биология окиси азота». Медицинский радиологический научный центр РАМН, Обнинск, 1999г.
2. А.А. Сосунов «Оксид азота как межклеточный посредник». Московский государственный университет им. Н.П. Огарева, Саранск.
3. И.П. Серая, Я.Р. Нарциссов «Современные представления о биологической роли оксида азота». Межрегиональный институт цитохимии, Москва, 2002г.
4. О.Ю. Колесниченко, Л.М. Филатова, З.А. Кривицина, Ю.И. Воронков «Эндотелиальная дисфункция и метаболические эффекты оксида азота у человека», 2003г.
5. Г.А. Рябов, Ю.М. Азизов «Роль оксида азота как регулятора клеточных процессов при формировании полиорганной недостаточности». Учебно-научный центр МЦ УД Президента РФ, Москва.
6. Н.А. Виноградов «Антимикробные свойства окиси азота и регуляция ее биосинтеза в макроорганизме». Центральный НИИ эпидемиологии, Москва.
7. Брюне Б., Сандау К., Кнетен А. // Биохимия. - 1988.- Т. 63, №7. - С. 966-975.
8. Малкоч А.В., Майданник В.Г., Курбанова Э.Г. «физиологическая роль оксида азота в организме (Часть 1). http://www.dialvsis.ru/magazin/1_2_2000/no1.htm
9. Габбасов З.А., Попов Е.Г. «Изучение агрегационной активности тромбоцитов у больных с сердечно-сосудистыми заболеваниями методами лазерной агрегатометрии // Новости А/О ЮНИМЕД. 2001. Т.8. С.4.
10. Зеленин К.Н. «Оксид азота (II): Новые возможности давно известной молекулы.//Соросовский Образовательный Журнал. 1997.№10. С. 105-110.
11. Реутов В.П. «Цикл окиси азота в организме млекопитающих.// Успехи биол. химии. 1995. Т.35. С. 189-228.
12. Реутов В.П., Сорокина Е.Г., Охотин В.Е., Косицын Н.С. «Циклические превращения оксида азота в организме млекопитающих». М.: Наука, 1998. С. 156.
13. Малышев И.Ю., Манухина Е.Б. //Биохимия. 1998. Т.63. С.870.
14. Журавлева И.А., Мелентьев И.А., Виноградов И.А. //Клин. Медицина. 1997. Т.75. С.18.
15. Онуфриев М.В. // Бюл. эксперим. биологии и медицины. 1995. Т. 120. С.148.
16. Албертс А., Брей Д., Льюис Р. и др. «Молекулярная биология клетки: в 3 т.: Пер. с англ. 2-е изд. М.: Мир, 1994.