Роль биогенных нанокристаллов в работе биологической «машины времени»
|
|
[21 октября, 2012 г.] Биогенные магнитные нанокристаллы являются одним из звеньев, связывающих физическое время с биологическим. К сожалению, этот вопрос мало освещен в современной литературе, поскольку он находится на стыке биологических и физических наук. В данной статье рассмотрен механизм участия биогенных магнитных нанокристаллов в биологическом старении организма. Предполагается, что увеличение количества и размеров нанокристаллов в клетках, пространственная перегруппировка, межклеточный дрейф и модификация их кристаллической структуры оказывают существенное воздействие на протекание биологического времени. В заключении описана модель биологической «машины времени» и стратегия ее создания. | |
|
Старение - одна из немногих научных проблем, которая интересует абсолютно всех. | ||
|
От редакции В этой работе идет речь об интересном феномене - магниточувствительности биологических клеток, которая обеспечивается присутствием в цитоплазме железосодержащих магнитосом. Автор обсуждает гипотетический механизм, согласно которому магниточувствительность и процессы старения организма могут иметь непосредственную взаимосвязь. Редакция обращает внимание, что эти темы исследованы довольно плохо, и «общепринятой» точки зрения по ним не существует.Магнитные нанокристаллы в живом организмеСреди факторов, оказывающих формирующее действие на развитие биосферы, следует выделить геомагнетизм и гравитацию, так как им присуща четко выраженная периодичность, которая, возможно, послужила основой для синхронизации биоритмов различных организмов. Геомагнетизм и гравитация представляют собой идеальное средство коммуникации между средой и живыми системами, и, что особенно важно, они несут в себе полную пространственно-временную информацию о космических объектах [1]. В настоящее время установлено, что внутри организмов присутствуют нанокристаллы ферромагнитных минералов [2, 3], которые могут являться сенсорами физических полей (рис. 1). Было открыто более 12 минералов, образовавшихся в ходе естественной биоминерализации. Из них самым распространенным является магнетит (Fe3O4) [4]. Биогенные кристаллы магнетита обнаружены в мозге [5] и других органах человека [6], раковых клетках [4], в мозге птиц, в рыбах, в бактериях, насекомых, червях, водорослях и др. [7]. Биогенные частицы магнетита часто называют магнитосомами . 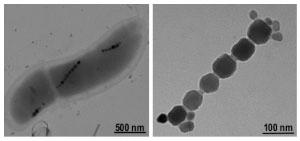
Рисунок 1. Биогенные кристаллы магнетита. Содержание магнитных нанокристаллов в тканях мозга человека составляет около 5×106 на грамм, в мозговой оболочке - более 108 на грамм, в среднем - 50 нг/г [8]. Около 90% частиц имеют размер 10-70 нм, а 10% обладают размером 90-200 нм. Частицы группируются в ансамбли по 50-100 штук [9]. Существует мнение, что навигационные способности большинства видов насекомых, рыб, птиц, рептилий, амфибий и млекопитающих обусловлены наличием магнитосом, которые выполняют функцию клеточного компаса* (рис. 2) [10-14]. * - А есть версия, что способность птиц ориентироваться по линиям магнитного поля Земли - по сути своей квантовое явление, использующее квантовую сцепленность пары электронов (см. «Зарождение квантовой биологии»). - Ред. М. Линдауэр установил, что пчелы могут получать информацию о времени из циклов геомагнитного поля, поэтому предполагается, что магнитные кристаллы могут участвовать в формировании чувства времени [10]. Минералы железа служат для осуществления широкого ряда функций по переносу и запасанию железа и удалению железосодержащих отходов жизнедеятельности [15]. При старении железо накапливается именно в тех областях мозга, которые поражаются при болезнях Альцгеймера и Паркинсона [16]. В то же время, установлено, что взрослые организмы содержат больше магнитного железосодержащего материала, чем молодые [10], поэтому биогенные кристаллы также рассматривают как одну из причин нейродегенеративных заболеваний [17, 18]. Транспорт железа в организме происходит с помощью хорошо известной системы трансферрина-рецептора трансферрин а [19], однако существует независимая от трансферрина система доставки [20]. Данные в пользу второй системы получены при изучении мышей и человека с нарушенной функцией трансферрина. Предполагают, что такая система функционирует на ранних стадиях эмбриогенеза [21]. П. Садлер с коллегами показал, что трансферрин in vitro может образовывать волокна, высвобождая микрокристаллы минерализованного железа [22]. Нельзя исключить, что именно эти микрокристаллы, которые, предположительно, начинают формироваться в эмбриогенезе с участием трансферрина, образуют в процессе своего роста магнитные кристаллические включения. 
Рисунок 2. Врожденная способность к навигации. Слева: Магнетит в клюве голубя является «биологическим навигатором» и помогает безошибочно преодолевать огромные расстояния. Справа: Летучие мыши ориентрируются по магнитному полю Земли, используя магнитные нанокристаллы для навигации. Существует также мнение, что продуцентами кристаллических частиц в организме могут являться нанобактерии * [23-27]. У некоторых видов магниточувствительных бактерий нанокристаллы синтезируются с участием белка MMS6 [28] и белков, кодируемых генами магнитосомного острова , однако механизм генетического контроля процессов формирования кристаллов до конца не расшифрован [29, 30]. * - Интересно, что нанобактерии - это вовсе не живые организмы, а субмикронные белково-минеральные частицы (см. «Бактерии из мéла»). - Ред. Самой распространенной точкой зрения является то, что магнитосомы образуются прямо в мозге [31], однако в отдельных работах предполагается, что нанообъекты могут проникать в организм из окружающей среды [32]. Последние достижения показали, что искусственные наночастицы способны поступать в мозг, преодолевая гемато-энцефалический барьер [33, 34]. Механизм транспорта в деталях не ясен, однако наиболее вероятным путем является пассивная диффузия и эндоцитоз эндотелиальными клетками капилляров головного мозга. Очевидно, исследованные наночастицы взаимодействуют с рецепторами к липопротеинам низкой плотности (ЛПНП) и могут быть поглощены эндотелиальными клетками. Кроме того, наночастицы могут подвергаться трансцитозу, подобно липопротеинам низкой плотности [34, 35]. В настоящее время известно, что некоторые кристаллы, в частности ферромагнетики, сами способны стареть и обладать эффектом памяти [36-39]. Возможно, что нанокристаллы биогенного магнетита могут быть внутриклеточными сенсорами хода физического времени. Поэтому актуальным вопросом будущих исследований станет выяснение роли модификации биогенных кристаллов в процессе старения клетки и организма. Участие магнитосом в развитии патологических процессов и возраст-зависимых измененийНедавно стало известно, что магнитосомы в трофоцитах пчел и в клетках магнитобактерий связаны с белками цитоскелета , которые отвечают за правильное расположение магнитосом и участвуют в магниторецепции. При этом возможно, что такие магнитосомы способны управлять клеточным «кукольным театром», где куклы - это органеллы, также связанные с цитоскелетом, магнитосомы - руки кукловода, а сознание кукловода - это магнитное поле, которое каждый день устраивает молекулярный спектакль (рис. 3). Авторы считают, что описываемая ими модель механизма магниторецепции у медоносных пчел может быть применена по отношению к большинству, а может - и ко всем магниточувствительным организмам [40, 41]. Магнитосомы, ассоциированные с цитоскелетом, могут быть одной из причин чувствительности биологических систем к слабым магнитным полям и вариациям геомагнитного поля, поскольку энергия таких частиц в магнитном поле существенно больше энергии тепловых флуктуаций [42]. Конечно, вопрос о прочности связи магнитосом с цитоскелетом остается открытым. 
Рисунок 3. Клетка - аналогия театра кукол. Можно предположить, что в процессе онтогенеза эта связь становится менее прочной, и что это может играть определённую роль в старении организма (рис. 4). Ослабление контактов магнитосом с белками цитоскелета может приводить к тому, что, оказавшись в клеточном пространстве, последние индуцируют механический стресс, воздействуя на медиаторы механотрансдукции - механочувствительные каналы , ядерную ламину, интегрины и др. [43]. Это может повлечь за собой определенные последствия: либо магнитосомы будут и далее находиться в свободном от цитоскелета состоянии, что, в конце концов, может привести к нарушению внутриклеточного гомеостаза и уникальной архитектуры клетки, либо блуждающие магнитосомы вновь зафиксируются в клетке в случайном положении, дезориентируя локальные внутриклеточные процессы. Поскольку количество магнитосомного материала увеличивается с возрастом, негативный дезориентирующий эффект от магнитосомно-зависимых процессов также должен возрастать. 
Рисунок 4. Альтернативные пути индукции магнитосомами биологического старения. Одной из причин ослабления магнитосомно-белковых связей могут являться изменения в структуре магнитосомы, которые обусловлены «старением» ее кристаллического вещества. Нельзя исключить, что уменьшение прочности связи магнитосомы с белками цитоскелета происходит вследствие модификации этих белков свободными радикалами (неспецифические посттрансляционные модификации, например карбонилирование), так как с возрастом происходит интенсификация свободно-радикальных процессов [44]. Также уменьшение силы магнитосомно-цитоскелетных контактов может происходить из-за протеолитической деградации цитоскелетных белков кальпаинами , которые являются ферментами Ca2+-зависимой протеолитической системы клетки [45]. При этом имеются экспериментальные данные о том, что в мозге с возрастом происходит закономерное повышение активности кальпаинов и продуктов их протеолитической активности, которыми являются пептоны цитоскелета [46, 47]. Эти процессы протекают из-за нарушений кальциевой регуляции, которые наблюдаются при старении мозга, инсультах и нейродегенеративных заболеваниях [48] и приводят к увеличению внутриклеточного содержания кальция в отдельных структурах мозга [49, 50]. Предполагается, что помимо возрастного снижения активности Ca2+-АТФ-азы сарко/эндоплазматического ретикулума [51, 52], концентрация цитозольного кальция может изменяться по магнитосомно-зависимому пути. Описывается возможный механизм активации магнитосомами механочувствительных кальциевых каналов, которые присутствуют почти во всех тканях [4]. Отмечается, что магнитосомы могут взаимодействовать с воротами кальциевых каналов посредством филаментов цитоскелета. В этом случае магнитосома, благодаря изменению своего положения во внутриклеточном пространстве, может переводить ворота кальциевого канала из закрытого положения в открытое и наоборот. По-видимому, увеличение количества и размеров магнитосом в ходе онтогенеза может приводить к вовлечению дополнительных механочувствительных кальциевых каналов в механизм их магнитосомной активации. Периодическая, зависимая от вариаций магнитного поля, гиперактивация механочувствительных каналов, возможно, служит причиной увеличения частоты осцилляционных потоков и концентрации кальция в цитоплазме, что и приводит в итоге к повышению ферментативной активности кальпаинов. Эта молекулярная армия кальпаинов, видимо, способна освобождать магнитосомы от «цитоскелетных оков» благодаря своим протеолитическим свойствам [53, 54]. Кристаллы магнитосом, теряя фиксированное положение и образуя при этом крупные конгломераты [55], начинают хаотически дрейфовать в клетке, нарушая процессы метаболизма. Кроме того, опубликовано много работ, посвященных влиянию механических воздействий на экспрессию генов фибробластов, хондробластов, остеобластов, миоцитов, клеток эндотелия, сетчатки и др. Эксперименты с культурами различных клеток показывают, что механические стимулы действительно вызывают увеличение концентрации внутриклеточного кальция, влияют на синтетические процессы (например, синтез ДНК), пролиферативную активность, ориентацию клеточных органелл, функционирование регуляторных механизмов [56, 57], а также повышают уровень свободно-радикального окисления биомолекул под действием активных форм кислорода (АФК). Молекулы АФК способны повреждать ткани, включая клетки мозга [58], а также участвуют в передаче биологической информации, необходимой для регуляции различных клеточных функций, в частности реализации апоптоза 
Рисунок 5. Отмена старения у лосося и изменение компасной навигации тесно связаны. Таким образом, увеличение количества и размеров магнитосом приводит к нарушению внутриклеточного гомеостаза и, возможно, является причиной возраст-зависимого изменения чувствительности нервной системы к воздействию электромагнитных полей [64]. Можно предположить, что с участием магнитосомной системы запускается механизм глубоких изменений эндокринной системы в процессе старения. Как известно, гормоны, имеющие гидрофильную природу (катехоламины, серотонин, белково-пептидные и др.), и нейротрансмиттеры накапливаются в клетке и выделяются в кровь определенными порциями за счет опустошения секреторных везикул. Экзоцитоз этих везикул происходит путем слияния с плазматической мембраной вследствие увеличения концентрации кальция [65, 66]. Как уже отмечалось выше, магнитосомы имеют тенденцию к увеличению размеров в процессе онтогенеза, что может влиять на амплитуду и частоту внутриклеточной осцилляции кальция и, как следствие, на биосинтез гормонов и периодичность их выброса в кровоток. Изменение частоты гормональных всплесков может происходить из-за более раннего или более позднего слияния накопившихся мембранных везикул с плазматической мембраной клетки за счет изменения силы и частоты осцилляционных потоков кальция. Было обнаружено также, что осцилляции цитозольного кальция позволяют снизить кальциевый порог при активации транскрипционных факторов, позволяющих клетке эффективно отвечать даже на низкие уровни стимулирующих агентов. В дополнение к этому выяснилось, что весьма важна не периодичность вообще, а вполне определенная частота осцилляций [67]. Таким образом, можно предполагать, что магнитосомы вносят свой вклад в развитие клеточных патологий, нарушая способность клетки адекватно откликаться на гормональные выбросы. Неоднородность клеточной среды обусловлена неодинаковым распределением отдельных ее компонентов (биомолекул, ионов, органелл и др.), которые формируют уникальную архитектуру клетки [68, 69]. Поскольку для протекания большинства клеточных процессов важна их определенная локализация, то обязательным условием поддержания клеточного гомеостаза является сохранение уникальности клеточной архитектуры. Можно предполагать, что в значительной мере она зависит от состояния магнитосомной системы клетки, которая претерпевает количественные и качественные изменения в ходе онтогенеза. Предполагается, что расположение магнитосом и сила их связи с цитоскелетом определяют способность к магниторецепции и лимитируют продолжительность клеточной жизни. Эта связь, в частности, прослеживается при отмене жемчужницей программы ускоренного старения у лосося. Замечено, что зараженные жемчужницей лососи (рис. 5) живут намного дольше, чем здоровые. Обычно лосось нерестится в горных реках, к которым он добирается благодаря компасной ориентации Предполагается, что магнитосомная система клетки способна оказывать влияние на структурное расположение и функциональную активность митохондрий благодаря активации кальпаин-зависимого протеолиза цитоскелета. Установлено, что дыхательный коэффициент митохондрий снижается при протеолитической обработке, нарушающей расположение митохондрий между саркомерами. Методом конфокальном микроскопии было описано нарушение в строении микротрубочек и сети плектина. Поэтому роль различных элементов цитоскелета и локализации митохондрий в регуляции дыхательной функции клетки in vivo высока [78]. Нельзя исключить, что прогрессирующее с возрастом магнитосомно-зависимое протеолитическое расщепление белков цитоскелета, определяющих структуру митохондриального ретикулума, способно нарушить его функциональную активность. Магнитосомы и десинхронизация биоритмовВ настоящее время установлено, что временную организацию всех биологических систем характеризует набор различных периодов с продолжительностью от нескольких минут до многих лет. С точки зрения мультиосцилляторной теории биоритмов, ритмическая деятельность сложных организмов основана на согласованной работе многих осцилляторов [79, 80]. Однако с возрастом происходит рассогласование (десинхронизация) биоритмов, приводящее к нейро-гуморальным расстройствам [79, 81, 82]. Предполагается, что одной из причин десинхронизации биологических ритмов является неодинаковый прирост магнитосомного материала в независимых клетках - водителях ритма, провоцирующий возрастное увеличение магниточувствительности одних таких клеток по сравнению с другими. Повышение магниточувствительности отделов мозга, отвечающих за генерацию осцилляций, может привести к значительному изменению амплитуды и фазы биоритмов за счет увеличения или уменьшения чувствительности к экзогенным воздействиям. Наиболее ярким примером является возрастное увеличение чувствительности эпифиза к действию переменного магнитного поля [83], которое подавляет секрецию основного его гормона - мелатонина - и сдвигает фазу циркадного ритма его секреции [79]. Поскольку мелатонин является ингибитором апоптоза, уменьшение его продукции может привести к увеличению числа клеток, вовлекаемых в апоптоз. Показано, что мелатонин негативно регулирует синтез мРНК, кодирующих рецепторы глюкокортикоидов, которые вызывают апоптоз клеток тимуса. Подавляя биогенез рецепторов для глюкокортикоидов, мелатонин защищает тимоциты от индуцируемой клеточной смерти [84]. Таким образом, неравнозначное магнитосомно-зависимое изменение магниточувствительности разных водителей ритмов приводит к сдвигу параметров биологических осцилляций и десинхронизации биоритмов организма. Почему люди стареют и возможно ли создание биологической машины времени?Так почему же люди стареют? Ответ на самом деле прост. Происходит уменьшение количества клеток во всех органах. Необходимо отметить, что потеря клеток в разных органах протекает с разной скоростью и, как следствие, процесс тотальной гормональной координации всех органов и систем при этом нарушается, что и способствует дополнительному увеличению темпов старения. Потеря клеток происходит вследствие нескольких взаимосвязанных причин. Во-первых, при воздействии мутагенов и при делении клетки происходят мутации, поскольку система репликации часто совершает ошибки при копировании ДНК и расхождении хромосом в процессе митоза. Когда клетки мутируют, в них могут включаться различные механизмы, приводящие либо к потере клеточных функций и самоуничтожению, либо к гиперустойчивости и увеличению лимита клеточных делений, иммортализации. Такие клетки могут дать начало доброкачественной или злокачественной опухоли, если они не будут вовремя ликвидированы в процессе апоптоза или иммунной системой организма. Поэтому старение является механизмом, защищающим организм от рака. Так возможно ли создание биологической машины времени? Ответить на этот вопрос можно только после построения единой компьютерной модели клетки и старения организма. В любом случае, создавая бессмертный организм или организм, способный путешествовать по биологическому пространству, необходимо научиться управлять количеством клеток во всех органах. При этом эти клетки должны быть способны к постоянному самообновлению, полной репарации генетических повреждений и иметь репликационную машину, работающую без ошибок. Это возможно благодаря искусственному созданию аутологичных синтетических клеток всех тканей с идеально скоординированным геномом, протеомом, метиломом и т.п. При этом возникнет серьезная проблема - отторжение этих клеток, поскольку вмешательство в геном приведет к потере аутологичных свойств. ЗаключениеРазумеется, магнитосомная система является лишь одной деталью в работе биологической машины старения. Какая же должна быть стратегия борьбы со старением? Для того, чтобы починить эту машину и настроить ее на вечное функционирование, необходимо иметь полное представление обо всех ее компонентах и функциях. После этого необходимо создать компьютерные модели идеальных клеток всех тканей организма человека*. Построение такой модели будет являться эскизом для создания синтетических клеток, обладающих идеальной регенерационной способностью, поддерживающих анатомическую целостность органов и не страдающих от онкологических трансформаций. Если такие клетки практически возможно получить, то проблема старения будет решена. * - Первые шаги в моделировании клетки «целиком» уже сделаны: см. «Рождение виртуальной клеточной биологии». О том, как математическое моделирование используется для решения биологических задач, см. статью «Пространственно-временное моделирование в биологии». Впрочем, по мнению редакции «биомолекулы», все это еще настолько далеко от перспектив, изображенных автором, что об этих перспективах пока можно лишь фантазировать. - Ред. 
Посвящается любимому человеку. Словарик
Список литературы
| ||
 Оглавление
Оглавление