Шанс на бессмертие
Кандидат биологических наук А. А. Кущ,
кандидат технических наук Л. Л. Литинская
Химия и жизнь №10, 1982 г., с. 56-60
Средство Макропулоса, описанное Карелом Чапеком, или эликсир Амбруаза Паре, секрет которого искали герои английского писателя Дж. Керша, - это вариации на излюбленную литературную тему: бессмертие и вечная молодость. Правда, писатели обращаются к вожделенным снадобьям лишь для того, чтобы показать, что бессмертию всегда сопутствует пресыщенность и духовное опустошение. Авторы этой статьи оставляют в стороне сложные нравственные и философские аспекты проблемы бессмертия и пробуют обсудить биологическую сущность самого явления.
Прежде всего стоит напомнить, что в реальной жизни никто и никогда не наблюдал феномена бессмертия (по крайней мере, у многоклеточных организмов). Но если предположить, что удалось бы остановить процесс старения организма, то такой организм мог бы жить бесконечно долго. Следуя этой логике, можно сказать, что разгадка бессмертия спрятана в тайне старения. Здесь нас прежде всего интересует процесс старения клеток живого организма.
ПОЧЕМУ КЛЕТКИ СТАРЕЮТ?
"Химия и жизнь" (1973, № 4) уже рассказывала о работах Л. Хайфлика, который двадцать лет назад показал, что клетки соединительной ткани (фибробласты) человека можно культивировать вне организма лишь ограниченное время - не более 40-60 клеточных поколений. Ограничение срока жизни оказалось справедливым и для фибробластов мыши, норки, курицы и даже галапагосской черепахи. Причем способность клеток к размножению (пролиферации) уменьшалась с возрастом донора и прямо зависела от средней продолжительности жизни, присущей тому или иному виду. Примечательно, что фибробласты, взятые у человека, страдающего прогерией, болезнью очень раннего старения, в культуре почти не размножаются.

Картина М. К. Чюрлениса "Сказка"
Переставшие размножаться фибробласты очень сходны с клетками стареющего организма. Это позволило отождествить активно делящиеся клетки с молодыми, а потерявшие способность к пролиферации - со старыми клетками. Так появилась очень удобная модель для исследования процесса старения клеток. Возраст клеток в такой модели определяется числом делений, прошедших от начала культивирования.
Сейчас в науке есть множество, числом около 300, теорий старения клеток. О них журнал не раз рассказывал читателям (см., например, "Химию и жизнь", 1976, № 12; 1977, № 5). Все эти теории можно условно разделить на две группы. Первая возлагает ответственность за старение на клеточное ядро или на ДНК, называемую даже "субстратом старения". Вторая акцентирует внимание на цитоплазме, в которой из-за ошибок синтеза постепенно накапливаются "неправильные белки". Один из видных представителей второго направления, Л. Оргел, дал смерти образное название - "катастрофы ошибок".
Итак, названы две инстанции, ведающие в клетке жизнью и смертью. Как выявить среди них главную? Здесь на помощь приходит клеточная инженерия.
КЛЕТОЧНАЯ ИНЖЕНЕРИЯ - ЧТО ЭТО ТАКОЕ?
Термин "инженерия" применительно к биологическим объектам означает направленное их конструирование или сборку из разных, порой совсем чужеродных частей. Процесс этот можно вести на любом уровне организации живой материи. Если это уровень многоклеточного организма, то результатом конструирования станет индивидуум, состоящий из клеток и тканей, принадлежащих различным видам. Правда, в мире животных таких примеров пока не найти, однако мифология охотно поставляет нам пищу для воображения. Тут и древнегреческая химера - чудовище с головой льва, туловищем козы и змеей вместо хвоста. (Кстати ее именем названы и другие подобные "конструкции".) И русалки, кентавры, сфинксы... Сюда же примыкают и вполне реальные растительные химеры (помидоры, привитые к картофелю, или яблони, ствол которых несет ветви других видов).
Получить жизнеспособные химеры среди животных довольно долго не удавалось из-за сильно выраженной реакции отторжения чужеродной ткани. Это затруднение удалось преодолеть на ранних стадиях эмбриогенеза, когда иммунологические механизмы защиты от чужого практически не работают. Так появилась пятнистая мышь - химера, у которой было две матери - белая и черная. У каждой из самок был взят эмбрион на очень ранней стадии развития; эмбрионы объединили, и сообща они дали начало новому химерному организму (см. "Химию и жизнь", 1978, № 9), в котором уживались вместе "черные" и "белые" клетки.
Работы, проведенные за последние 15-20 лет, позволили соединять клетки, взятые от совершенно разных видов животных. Такие слитые воедино клетки получили название уже не химер, а гибридов.
Вообще говоря, всем хорошо известен простейший пример гибридизации - это продукт слияния двух половых клеток, относящихся к разным видам. Например, мул - это гибрид лошади и осла. Немало гибридов знаем мы в растительном мире.
Однако оказалось, что в единое целое могут объединяться не только половые клетки.
В 1960 г. английский биолог Дж. Барский, культивируя в одном сосуде сразу две различные линии клеток, обнаружил, что у некоторых клеток хромосом было больше, чем полагалось. Барский предположил, что это было результатом случайного объединения клеток. Сначала сообщение о слиянии соматических (то есть не половых) клеток было встречено с недоверием, но последующие работы подтвердили факт спонтанной гибридизации клеток. Правда, гибридные клетки возникали очень редко, один раз на десять - сто тысяч случаев. Поэтому надо было как-то подстегнуть процесс слияния.
Задачу решили с помощью вируса Сендай, который примерно в сто раз усиливает эффект слияния клеток, изменяя их наружную оболочку. Недавно появился еще один способ добиться той же цели. Клетки обрабатывают синтетическими полимерами, например полиэтиленгликолем, которые тоже меняют свойства оболочки и облегчают слияние.
Но получить гибридные клетки - этого еще мало. Дело в том, что они оказываются перемешанными с родительскими клетками, которые оказываются в явном большинстве. И выделить гибриды из этой смеси - задача крайне сложная. Не выбирать же микроскопические клетки из сосуда по одной...
Подходящий способ был найден в 1964 г. английским цитологом Дж. Литтлфилдом. Он предложил помещать смесь родительских и гибридных клеток в такую среду, в которой родительские клетки погибали бы, а гибридные могли бы выжить. Его расчет был вполне обоснован.
У клетки есть два пути синтеза нуклеотидов (звеньев, из которых строятся нуклеиновые кислоты). Один - основной, при котором используются сахара и аминокислоты, второй - резервный, когда в ход идут продукты метаболизма клетки - гипоксантин и тимидин. Резервным синтезом ведают два специализированных фермента.
Дж. Литтлфилд выбрал две линии мутантных клеток, в одной отсутствовал первый из этих ферментов, в другой - второй. Естественно, резервный путь синтеза для той и другой линии был закрыт. В обычных условиях, когда в культураль-ной среде есть сахара и аминокислоты, мутанты нормально растут и размножаются, так как синтез нуклеиновых кислот идет в них по основному пути. Но если в питательную среду ввести вещество аминоптерин, препятствующее основному пути синтеза, то клетки погибают.
Точнее, погибают все клетки, кроме образовавшихся гибридов. И это понятно. Ведь каждая из родительских клеток была "дефектна" только по одному ферменту, а второй, необходимый для резервного синтеза, в ней присутствовал. Поэтому гибридные клетки, располагая уже обоими ферментами, размножались, используя запасной вариант.
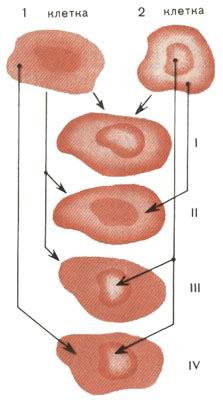
Рис. 1. Семейство гибридных клеток: I - гибридная клетка; II - гибрид = клетка 1 + цитоплазма 2; III - кариобрид = клетка 1 + ядро 2; IV - реконструированная клетка = цитоплазма 1 + ядро 2
Так был придуман способ выделения гибридных клеток из смеси клеточных культур. Селективная среда, предложенная Литтлфилдом, была названа ГАТ - от гипоксантина, аминоптерина, тимидина. Перед методом гибридизации соматических клеток открылись широкие возможности. Правда, всякий раз приходится выводить мутанты тех клеток, на основе которых предполагается конструировать гибриды. Но можно пользоваться и готовыми мутантными линиями, которых к нынешнему времени накопилось в мировых коллекциях уже немало.
Сейчас умеют создавать самые разные клеточные гибриды. Семейство их изображено на рис. 1. Клетку, если надо, лишают ядра, оставляя только цитоплазму, или, наоборот, сохраняют только ядро, окруженное лишь тонким слоем цитоплазмы. Возникли новые диковинные названия. Гибрид целой клетки с клеткой, утратившей ядро, получил название цибри-да. Гибрид целой клетки с ядром из другой клетки назвали кариобридом. Гибрид безъядерной цитоплазмы одной клетки с ядром другой клетки - это новая, реконструированная клетка. Такова вкратце кухня изготовления клеточных гибридов.
Соединяя фрагменты различных клеток в единое целое, можно оценить вклад каждого из них в ту или иную клеточную функцию. Вот тут мы и вернулись к основной теме статьи - к поиску причин старения клетки, к выявлению главной инстанции, ведающей часами жизни.
"МОЛОДАЯ" ЦИТОПЛАЗМА - "СТАРОЕ" ЯДРО
В 1975 году У. Райт и Л. Хайфлик получили разные варианты цибридов, сливая фибробласты человека с такими же клетками, но лишенными ядра. К сожалению, для выделения цибридов нельзя было использовать систему ГАТ, так как исследователи работали не с мутантными, а с полноценными клетками. Поэтому пришлось разработать новый, оригинальный метод выделения гибридных клеток.
У одних клеток удаляли ядра. А у других сохраняли и ядро, и цитоплазму, но предварительно их "отравляли" веществом, препятствующим синтезу АТФ, после чего цитоплазма становилась неактивной. Затем "отравленные" клетки и безъядерные фрагменты сливали. У родителей не было шансов выжить. А вот возникающие цибриды получали от одного родителя нормальное ядро, способное к синтезу ДНК, и нормальную, неотравленную цитоплазму от другого родителя. Поэтому они оказывались жизнеспособными. Метод, предложенный Райтом и Хайфликом, получил название "спасения" отравленных клеток.
Райт и Хайфлик брали молодые и старые фибробласты и соединяли их фрагменты в разных сочетаниях. Коротко об этих работах "Химия и жизнь" уже сообщала (см. 1978, № 9). Напомним основные выводы этих исследований. Старая цитоплазма, объединенная с молодой клеткой, не сокращала продолжительности ее жизни. А молодая цитоплазма, в свою очередь, не увеличивала время жизни старых клеток. Поэтому авторы работы сделали вывод, что на процесс старения цитоплазма не влияет. Однако, как показали дальнейшие эксперименты, вывод был несколько поспешным. Ведь для получения цибридов применяли отравляющие вещества, которые могли повлиять на цитоплазматические факторы старения.
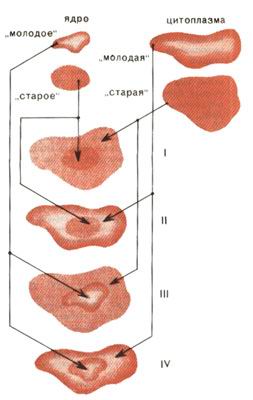
Типы реконструированных клеток и их дальнейшая судьба: I - "старое" ядро + "старая" цитоплазма (нет делений, гибель через 4 недели); II - "старое" ядро + "молодая" цитоплазма (нет делений, гибель через 4 недели); III - "молодое" ядро + "старая" цитоплазма (3 деления, гибель через 16 недель); IV - "молодое" ядро + "молодая" цитоплазма (больше 3 делений, живут более 16 недель)
В 1979 г. А. Магглтон-Харрис и М. Пеламбо сконструировали кариобриды на основе старых клеток, взятых целиком, и ядер, заимствованных из молодых или старых клеток. Было показано, что старая клетка резко сокращает срок жизни молодого ядра. Но оставалось по-прежнему неясным, что именно - ядро или цитоплазма старой клетки - отвечает за преждевременное старение молодого ядра.
Пожалуй, самые четкие сведения о роли цитоплазмы и ядра в процессах старения были получены при исследовании реконструированных клеток. Оказалось, что как старое ядро, так и старая цитоплазма резко уменьшают продолжительность жизни реконструированной клетки (рис. 2). Следовательно, процесс старения находится под контролем и ядра, и цитоплазмы. А раз так, то ни одна из существующих на сегодня трехсот теорий старения клеток не может быть признана абсолютно правильной.
Попробуем теперь тот же вывод сформулировать по-иному. Реконструированная клетка, полученная из старого ядра и молодой цитоплазмы, оказывается старой. Отсюда следует, что молодая цитоплазма не в силах омолодить старое ядро. Ненамного долговечней оказывается конструкция из молодого ядра и старой цитоплазмы.
Отсутствие эффекта омоложения старых клеток или их фрагментов значительно уменьшает шансы на возможность бессмертия.
И ВСЕ ЖЕ - ЕСТЬ ЛИ НАДЕЖДА?
Если к бессмертию подходить с позиций продолжительности жизни клеточных популяций, то обнаруживается любопытный факт. Трансформированные клетки и клетки злокачественных опухолей обладают неограниченной способностью к размножению вне организма и, следовательно, в рамках рассматриваемой модели могут быть расценены как бессмертные.
Можно ли это свойство передать нормальным клеткам? В поисках ответа английские биологи С. Банн и И. Таррант в 1980 г. исследовали гибриды "бессмертных" опухолевых клеток с молодыми и старыми фибробластами. Выяснилось, что независимо от возраста фибробластов гибридные клетки в обоих случаях давали приблизительно равное и строго ограниченное число поколений - около 20. Лишь один клон из девятнадцати, образовавшихся при слиянии опухолевых клеток со старыми фибробластами, и три из тридцати восьми - при слиянии с молодыми проявили признаки бессмертия. Следовательно, такие события чрезвычайно редки.
Главный вывод, который отсюда следует: способность беспредельно размножаться не оказалась доминантным признаком. Этот результат подтвержден и в других опытах на цибридах и кариобридах опухолевых и нормальных клеток. Ни "бессмертное" ядро, ни "бессмертная" цитоплазма, будучи введены в обычные старые клетки, не делают их вечными. Хотя некоторое омоложение клеток при этом все же наблюдается. Многие из старых клеток после слияния с клетками опухолевыми вступают в период синтеза ДНК, а иногда проходят 2-3 или даже 20 делений. Следовательно, и в ядре, и в цитоплазме бесконечно пролиферирующих клеток содержатся омолаживающие факторы. Омолаживающие, но не приводящие к бессмертию.
В заключение коснемся еще одного, быть может, самого интересного аспекта экспериментов по изучению старения клеток. По-видимому, читатель уже обратил внимание на то, что нормальные клетки ограничивают пролиферацию опухолевых клеток. Так, может быть, гибриды нормальных и опухолевых клеток подскажут, как обуздать бесконечный рост злокачественных клеток?
Кстати, еще один очень важный момент. В тех случаях, когда гибриды нормальных и опухолевых клеток все же сохраняют способность к неограниченному делению, они сохраняют и свою злокачественность - при введении в организм дают начало росту злокачественной опухоли.
И все же такие гибриды оказались очень ценным приобретением для науки. Речь идет о гибридомах - соединении опухолевых клеток миеломных линий с нормальными В-лимфоцитами, извлеченными из селезенки животного. Эти гибридомы, сохраняя способность бесконечно размножаться, производят белки-иммуноглобулины. Клоны таких клеток - это по существу миниатюрные фабрики, производящие крайне необходимые медицине белки. Именно с гибридомами связан так называемый иммунный бум в фармацевтической промышленности (см. "Химию и жизнь", 1980, № 7). Это направление успешно развивается и у нас в стране - в Онкологическом научном центре, в Институте вирусологии АМН СССР и в Институте молекулярной биологии АН СССР.
Ну, а средство Макропулоса? Увы, настоящее бессмертие так и останется уделом только литературных героев...