Индукция плюрипотентности в соматических клетках сопровождается обновлением способности «старых» митохондрий к производству энергии
Известно, что индукция плюрипотентности «перезапускает» счетчик клеточных делений за счет активации теломеразы и удлинения теломер [1]. То есть возраст клеток, выраженный в длине теломер, обнуляется. А что происходит с другими характеристиками клеточного возраста, например, с энергетическим ресурсом митохондрий? Известно, что в процессе старения соматических клеток эффективность работы митохондрий падает, в частности за счет накопления мутаций в мхДНК [2]. Хотя интенсивность дыхания в митохондриях меняется при репрограммировании фибробластов, а затем при дифференцировке индуцированных плюрипотентных стволовых клеток (иПСК) [3, 4], ранее не сообщалось о существенных отличиях митохондрий клеток полученных из иПСК от митохондрий исходных фибробластов.

Ученые из Мичиганского государственного университета (Michigan State University) под руководством доктора Хосе Сибелли (Jose Cibelli) сделали недавно важное заявление - эффективность работы митохондрий в потомках иПСК гораздо выше, чем в исходных фибробластах. По-видимому, возвращение клетки к статусу плюрипотентной приводит к «обновлению» митохондрий (рис. 1).
Для исследования авторы взяли две культуры фибробластов человека - FIBA и FIBB - полученные от индивидуумов двух разных возрастов (16 я неделя внутриутробного развития и 70 лет, соответственно). При этом из за большой скорости деления и большего числа пассажей в культуре клетки FIBA были сравнимы по возрасту с недавно полученными и медленно делящимися клетками FIBB - обе культуры были «старыми» и имели укороченные теломеры [1]. Затем при помощи ретровирусной трансдукции транскрипционных факторов с-MYC, OCT4, KLF4, LIN28 и NANOG ученые получили из исходных фибробластов две линии иПСК (IPSA и IPSB, соответственно). Линии иПСК были сходны между собой, а также с эмбриональными стволовыми клетками (ЭСК) человека по морфологии, экспрессии маркерных генов, глобальному профилю метилирования генома, были способны к образованию тератом и имели удлиненные теломеры [1]. Затем иПСК обеих линий вновь дифференцировали. Для этого фрагменты тератом культивировали in vitro, а мигрировавшие из них клетки пассировали в условиях благоприятных для роста фибробластов. Это делалось для того чтобы увеличить число клеточных делений и вызвать таким образом интенсивное старение дифференцированных клеток. В результате авторы работы получили две культуры фибробласт-подобных клеток - TERA и TERB, в зависимости от того, от какой линии иПСК происходила тератома. TER клетки имели морфологию фибробластов с маленьким ядерно цитоплазматическим отношением, профиль метилирования ДНК характерный для фибробластов, экспрессировали фибронектин - маркерный белок фибробластов, а их теломеры вновь становились укороченными [1].
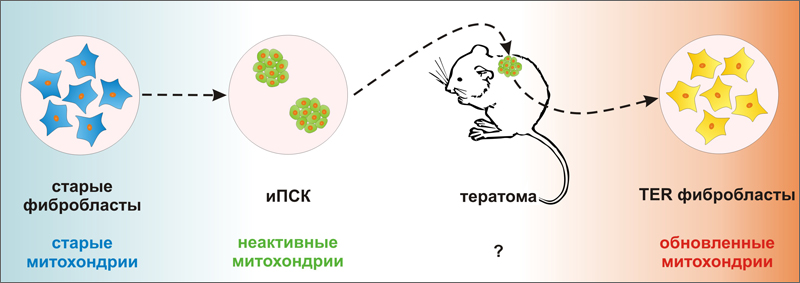
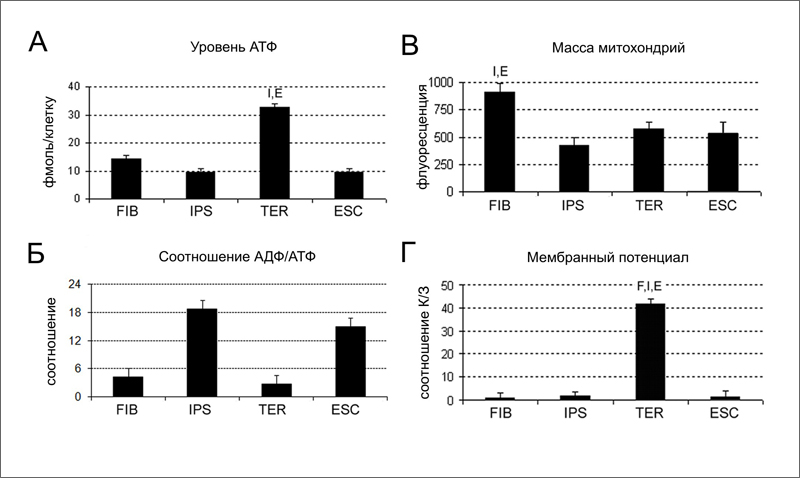
Задачей исследователей было, используя имеющиеся клетки, изучить эффективность работы митохондрий в ходе репрограммирования и повторной дифференцировки. Для сравнения использовали также две линии ЭСК человека. Авторы измеряли четыре параметра:
• уровень АТФ в клетке - баланс между образованием АТФ в ходе окислительного фосфорилирования и гликолиза, и расходованием АТФ на метаболизм клетки;
• соотношение АДФ/АТФ - тем выше, чем хуже идут в клетке процессы производства АТФ;
• массу митохондрий в расчете на одну клетку;
• мембранный потенциал митохондрий.
Из всех исследованных типов клеток TER клетки обладают наиболее высоким уровнем АТФ (32,84 фмоль/клетку), значительно отличаясь от иПСК и ЭСК, которые имеют одинаково низкий уровень АТФ (9,40 и 9,49 фмоль/клетку, соответственно) (рис. 2A). Исходные FIB клетки имеют средний уровень АТФ (14,21 фмоль/клетку), ближе к плюрипотентным клеткам (рис. 2A). Низкий уровень АТФ в плюрипотентных клетках объясняется низким уровнем дыхания [3, 4], о чем говорит и высокое соотношение АДФ/АТФ в этих клетках (рис. 2Б). Масса митохондрий снижается при репрограммировании вдвое (рис. 2В). Это хорошо согласуется с данными о подавлении дыхания в плюрипотентных клетках [3, 4]. Однако после дифференцировки иПСК масса митохондрий в TER клетках остается по-прежнему низкой (рис. 2В), хотя дыхание активируется. В результате TER клетки в сравнении с FIB клетками имеют в 1,5 раза меньше митохондрий, которые, однако, производят в 2 раза больше АТФ. О высокой активности митохондрий TER клеток говорит и высокое значение их мембранного потенциала (рис. 2Г). Исследователи не обнаружили различий между клетками TERA и TERB, ведущими происхождение от индивидуумов разных возрастов. Таким образом, эффективность работы митохондрий резко возрастает при прохождении клетки через плюрипотентное состояние.
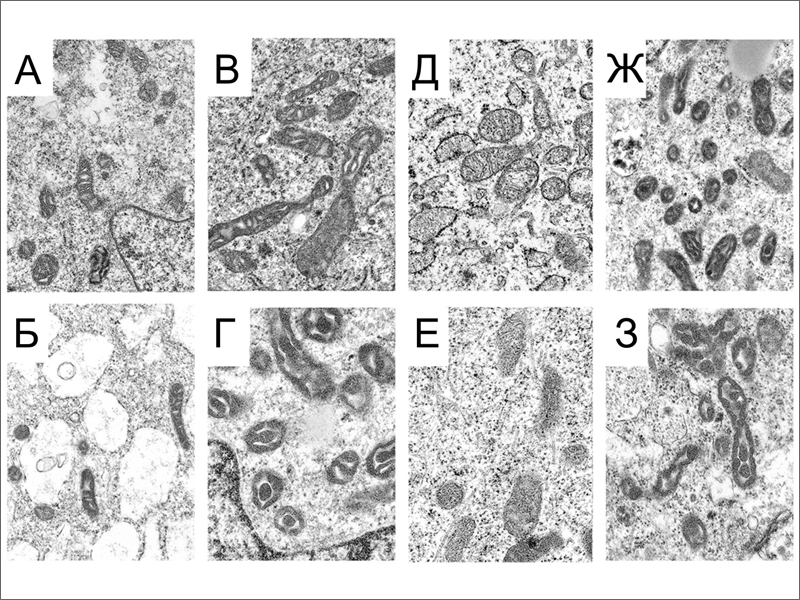
Морфологию митохондрий в исследуемых клетках изучили при помощи 3D электронной томографии и просвечивающей электронной микроскопии. Было выявлено три типа ультраструктурной организации митохондрий (рис. 3). Митохондрия ортодоксального типа на срезе имеет плотно упакованные, тонкие кристы и полупрозрачный матрикс. Митохондрия конденсированного типа, наоборот, имеет темный матрикс и увеличенные, полупрозрачные кристы. И, наконец, в ультраконденсированном состоянии матрикс еще более уплотнен, а кристы сливаются в единую структуру. Исследователи подсчитали долю ортодоксальных и обоих типов конденсированных митохондрий во всех четырех типах клеток. Они обнаружили, что в FIB клетках, иПСК и ЭСК ортодоксальную конфигурацию имеют меньше 50% митохондрий, тогда как в TER клетках их доля превышает 90% (рис. 3). Авторы связывают доминирование митохондрий ортодоксальной конфигурации с благоприятным энергетическим статусом TER клеток.
Группа Хосе Сибелли изучала энергетику репрограммированных клеток, чтобы понять смогут ли эти клетки нормально функционировать после трансплантации. Например, для замещения дефектных популяций кардиомиоцитов или нейронов - клеток, в норме обладающих высоким уровнем дыхания, - пересаживаемые клетки должны также эффективно производить АТФ. Если бы иПСК полученные из исходно «старых» фибробластов давали при дифференцировке производные с неэффективными митохондриями, непригодные для трансплантации, то для клеточной терапии необходимым условием стало бы наличие исходных эмбриональных или фетальных клеток. Исследователям, однако, удалось показать, что репрограммирование «обновляет» способность митохондрий к производству энергии. Результат этот обнадеживающий, но, все же, странный.
Известно, что геном митохондрий подвержен мутагенному воздействию активных форм кислорода (АФК), которые возникают из-за «утечки» высокоэнергетических электронов из дыхательной цепи [5]. Для поддержания генома митохондрий в ряду поколений существует специальный биологический механизм. Так, митохондрии в клетках полового пути лягушки Xenopus laevis остаются «выключенными» в отношении интенсивности дыхания на протяжении больше чем 70% 2 летнего жизненного цикла [6]. Половая клетка большую часть времени использует АТФ образованную в ходе гликолиза, либо поступающую извне. Те 30% времени, когда клетка использует собственное окислительное фосфорилирование, приходятся на периоды наибольшей потребности в АТФ - на время миграции первичных половых клеток и на стадии II-III оогенеза, когда синтезируется большая часть желтка [6]. Такой механизм снижает мутагенное воздействие АФК на генетический материал митохондрий полового пути.
В процессе старения терминально-дифференцированных соматических клеток в их митохондриях накапливаются мутации мхДНК [7], что приводит к снижению эффективности работы электрон-транспортной цепи и уменьшению образования АТФ [2]. Эти нарушения тем интенсивнее, чем интенсивнее клеточное дыхание - больше всего страдают сердце, мозг и другие неустойчивые к гипоксии ткани и органы [5]. Непонятно, каким образом репрограммирование может исправить эти нарушения и придать митохондриям соматических клеток изначальную активность, на уровне активности в клетках новорожденного?
Сомнительно, что происходит исправление накопленных мутаций мхДНК. Возможно, сигнальные пути, которые активируются в стареющих клетках, ингибируют дыхание в митохондриях. Тогда подавление этих сигнальных путей при переходе фибробластов к плюрипотентному состоянию само по себе скажется на уровне дыхания.
Известно, что мыши в отличие от человека имеют резерв длины теломер и могут несколько поколений жить с нокаутированным геном теломеразы [8]. Затем теломеры укорачиваются до критической длины и появляются нарушения [8]. Возможно, какой-то резерв имеется и у митохондрий животных. Интересно, появятся ли нарушения, если на протяжении нескольких поколений мышей получать потомков из соматических клеток предков посредством индукции плюрипотентности и тетраплоидной комплементации?
Другим возможным объяснением «обновления» митохондрий может быть селекция немутантных вариантов мхДНК. Показано, что накопление всего 30% делетированных мхДНК в клетке уже вызывает снижение продукции АТФ [2]. С другой стороны известно, что в гаметогенезе происходит селекция митохондрий, при которой в клетке размножаются только несколько вариантов мхДНК [9]. Если подобная элиминация мутантных мхДНК происходит в процессе репрограммирования, либо при последующей интенсивной дифференцировке клеток, то это может объяснять наблюдаемое повышение эффективности работы митохондрий в клетках-потомках иПСК.
Так или иначе, но полного возврата митохондрий к эмбриональному фенотипу и не требуется для клинического применения потомков иПСК. Возможно, обнаруженное Хосе Сибелли с коллегами «омоложение» митохондрий при репрограммировании дает им достаточный резерв активности для еще некоторого числа клеточных делений, что необходимо для реализации протоколов заместительной клеточной терапии.
По материалам:
Библиография
1. Suhr S.T., Chang E.A., Rodriguez R.M. et al. Telomere dynamics in human cells reprogrammed to pluripotency. PLoS One 2009; 4(12): e8124. [Abstract]
2. Prigione A., Cortopassi G. Mitochondrial DNA deletions induce the adenosine monophosphate-activated protein kinase energy stress pathway and result in decreased secretion of some proteins. Aging Cell 2007; 6(5): 619-630. [Abstract]
3. Armstrong L., Tilgner K., Saretzki G. et al. Human induced pluripotent stem cell lines show stress defense mechanisms and mitochondrial regulation similar to those of human embryonic stem cells. Stem Cells 2010; 28(4): 661-673. [Abstract]
4. Prigione A., Fauler B., Lurz R. et al. The senescence-related mitochondrial/oxidative stress pathway is repressed in human induced pluripotent stem cells. Stem Cells 2010; 28(4): 721-733. [Abstract]
5. Szibor M., Holtz J. Mitochondrial ageing. Basic Res. Cardiol. 2003; 98(4): 210-218. [Abstract]
6. Kogo N., Tazaki A., Kashino Y. et al. Germ-line mitochondria exhibit suppressed respiratory activity to support their accurate transmission to the next generation. Dev. Biol. 2010; in press. [Abstract]
7. Nekhaeva E., Bodyak N.D., Kraytsberg Y. et al. Clonally expanded mtDNA point mutations are abundant in individual cells of human tissues. Proc. Natl. Acad. Sci. U. S. A.2002; 99(8): 5521-5526. [Abstract]
8. Lee H.W., Blasco M.A., Gottlieb G.J. et al. Essential role of mouse telomerase in highly proliferative organs. Nature1998; 392(6676): 569-574. [Abstract]
9. Wai T., Teoli D., Shoubridge E.A. The mitochondrial DNA genetic bottleneck results from replication of a subpopulation of genomes. Nat. Genet. 2008; 40(12): 1484-1488. [Abstract]