Аутоиммунный бунт конца жизни
С возрастом в клетках человека накапливается много молекулярного мусора

Страдания при аутоиммунных заболеваниях усугубляются досадой: ведь их причиняет та самая функция организма, которая призвана его защищать. Иммунная система даёт сбой и начинает убивать клетки самого организма. Сидром Съегрена - патология желез, вызванная аутоиммунными нарушениями. Характерные признаки этого нарушения - сухость глаз, носа, гортани и других слизистых оболочек. Фото (): |
Более столетия назад выдающийся российский ученый (1845-1916) макрофага - клетки, которая в нашем организме. Мечников открыл клетку мощной и весьма разноликой системы - иммунитета. Сегодня изучены и иммунной системы -
Стражи иммунной системы постоянно «прощупывают» весь организм на предмет чужеродных клеток. Когда
Однако известно много случаев сбоя в работе иммунитета, когда клетки иммунной системы принимают клетки своего организма за чужие и атакуют их - подобно мятежным войскам, направляют свой удар на тех, кого они призваны защищать.
Аутоиммунные заболевания - это серьёзная медицинская проблема современного человечества. В настоящее время иммунологам известно более восьмидесяти разновидностей подобных расстройств, многие из них приводят к тяжелым страданиям, ограничению физических возможностей и даже смертельному исходу.Аллергия, рассеянный склероз, красная волчанка, диабет I типа, ревматоидный артрит - все эти и многие другие расстройства связаны со сбоем в работе иммунитета.
Предъявите паспорт!
В период внутриутробного развития или сразу после рождения иммунная система человека проходит специальную подготовку, чтобы не реагировать на собственные молекулы - затесавшиеся среди миллиардов лимфоцитов несколько «изменников», нападающих на своего хозяина, либо уничтожаются, либо выводятся из игры. В большинстве случаев этого оказывается достаточно для «подавления восстания». Но время от времени одна из
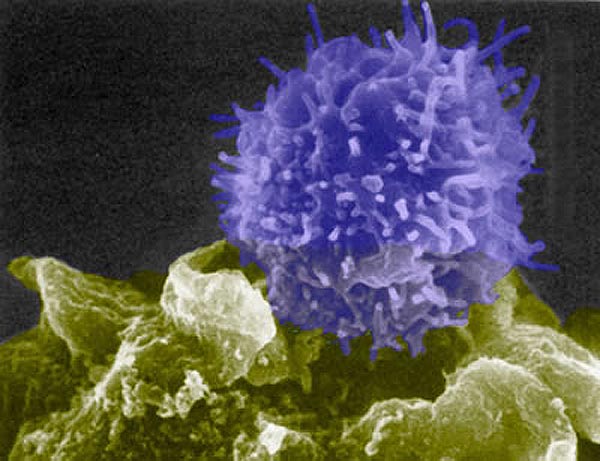
Т-лимфоцит (синий) проверяет клетку (зелёную) на предмет чужеродности. Если клетка не прошла контроль, Т-лимфоцит тут же даст команду другим клеткам уничтожить её. Фото: Berkeley Lab |
Почему иммунные лимфоциты вдруг начинают атаковать клетки собственного организма, разобраться не
Войско мятежников
Сложность в том, что из-за мутаций «чужые» антигены могут появляться на поверхности здоровой клетки. Например, «точечные» мутации - самые простые - проявляются в замене одной буквы
Более того, мутации могут наблюдаться и в клетках самой иммунной системы. Аутоиммунные (бракованные) лимфоциты могут
Классический пример аутоиммунного расстройства - диабет I типа, при котором

При диабете I типа из-за аутоиммунного нарушения организм производит недостаточное количество гормона инсулин. Восполнять недостаток приходится с помощью инъекций. Фото (): |
Вполне возможно, что аутоиммунные процессы оказывают и более глобальное воздействие на наш организм. Речь идёт о не столь уж приятном, но биологически закономерном старении клеток и организма в целом.
Старение - аутоиммунная «болезнь»?
В разные времена существовало множество воззрений на старение. Альфред Уоллес (, 1823-1913), провозглашаемый «сподвижником» Чарльза Дарвина (, 1809-1882), полагал, что старость человека запрограммирована, чтобы избежать конкуренции с потомками. Его идею развили генетики, которые в 1920-х годах
Механизмы старения, поиск связи процессов старения и работы иммунной системы организма волнуют учёные умы многие десятилетия. К сожалению, мимо внимания большой науки прошло открытие Клайва Маккея (), работавшего в Корнеллском университете (). А Маккей ещё в 1930 году в экспериментах на крысах доказал, что сокращение числа калорий на треть на ту же величину продлевает их жизнь! Это удивительное явление получило название «калорическая рестрикция», то есть «урезание калорий».
Значительно большее внимание ученых привлекло сообщение Денхама Хармана (), профессора университета Небраски, опубликованное в 1956 году в «Геронтологическом журнале» (). Согласно свободнорадикальной теории () Хармана, в процессе жизнедеятельности в нашем организме образуются агрессивные формы кислорода - свободные радикалы, или оксиданты. Они легко вступают в реакции, разрушая молекулы, клетки, и вызывают клеточные мутации.
Изучение маленького почвенного червячка , у которого всего лишь тысяча клеток и геном которого геном давно прочитан, позволило выделить и изучить гены старения. Пятнадцать лет назад Синтия Кеньон () из Калифорнийского университета в
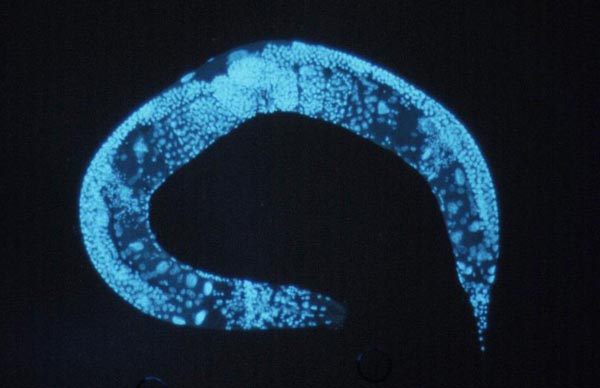
Изучать, как происходит процесс старения на уровне генов, легче на червяках, геном которых уже прочитан. Эксперименты с генами червяка Саеnorabditis elegans позволили существенно продлить ему жизнь. Как продлить жизнь человеку - пока загадка. Фото: National Human Genome Research Institute |
Нормальная клетка в здоровом организме постоянно находится перед дилеммой: либо выполнять очередное деления, либо перейти к апоптозу - генетически запрограммированной смерти, защищающей весь процесс деления от сбоев. Важным открытием начала геномного миллениума было выделение и характеристика. В опытах на мышах с иммунодефицитом, то есть с отключенной реакцией отторжения, эти клетки были готовы в любой момент воспроизвести опухоль, не поддающуюся ни облучению, ни химиотерапии. Ученые выяснили, что устойчивость опухолевых клеток к внешним воздействиям связана с резким усилением функции ферментов «починки» (репарации) ДНК, вещества наших генов. Известно также, что в раковых клетках необычайно активен и фермент теломераза. Его функция заключается в удлинении ДНК на концах хромосом, называемых теломерами. Несмотря на теломеры длина нормальной ДНК с каждым новым делением клетки уменьшается, и когда она достигает минимального предела, клетка должна погибнуть. В раковых клетках из-за активной работы фермента теломеразы уменьшения длины ДНК нет, поэтому они безостановочно делятся.
Второе большое открытие связано с тем, что клетки от перерождения их в раковые защищает процесс старения - постепенно в клетках «выключается» один протеиновый каскад за другим, что способствует, например, снижению тех же энергетических потребностей человека (хотя субъективно это воспринимается как повышенная утомляемость и снижение работоспособности). Параллельно этому процессу угасает и «резкость» иммунного ответа: если в 16 лет тимус человека производит
Перечисленные результаты исследований позволяют нарисовать общую картину: потребление пищи приводит к росту концентрации свободных радикалов, «рвущих» ДНК, что требует обязательного восстановления её целостности с помощью ферментов «починки». Однако копирование ДНК неизбежно приводит к
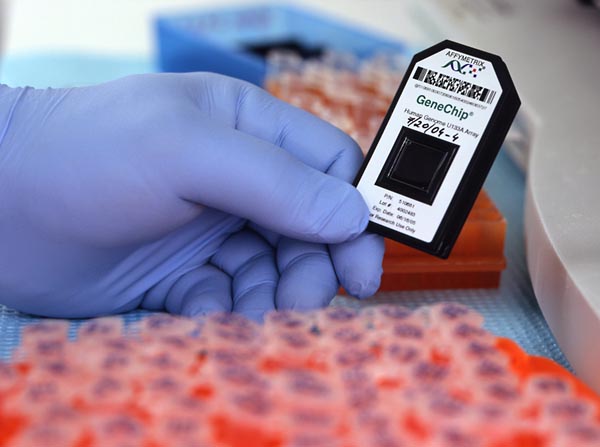
Такие ДНК-чипы позволяют выявить гены-мутанты, ставшие причиной аутоиммунных нарушений человека. Фото: Rhoda Baer/NIAMS/NIH |
(преждевременное старение), вызываемая мутацией в гене ламина, доказывает тот факт, что чрезмерная активация генов может приводить к «сгоранию» практически всех стволовых клеток ещё в первые годы жизни ребенка. Без активности стволовых клеток невозможно поддержание иммунного ответа, роста волоси ногтей, кожи и «смены» слизистой. Если стволовые клетки не могут обеспечить «самообновления» тканей и органов, развиваются болезни. В то же время небольшие количества белка прогерина в клетках способствуют их нормальному старению у людей пожилого возраста.
Включение аутоиммунного ответа лимфоцитов может являться естественным молекулярным механизмом нормального старения, проявляющегося у разных людей с той или иной скоростью, в результате чего одни живут до восьмидесяти лет, а некоторые и до ста двадцати.
Сегодня врачи уже имеют в своем распоряжении целый набор иммуномодуляторов и даже иммунодепрессантов, которые подавляют чересчур активные клетки иммунной системы. Но их применение пока оправдано лишь при трансплантации органов и тканей, поскольку они уж слишком рьяно «давят» иммунную реакцию. Механизм действия этих веществ заключается в блокировании протеинов иммунных лимфоцитов. А нужны такие иммуноактивные «субстанции», которые, проникая в ядра этих клеток, мягко регулировали бы активность нужных
Вероятно, время, когда в распоряжении врачей появятся подобные «мягкие» активаторы или блокаторы, не за горами. И тогда можно будет говорить о реальной приостановке процессов старения и эффективном продлении активной жизни без болезней и сопровождающего старость ухудшения качества жизни.